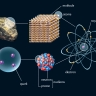
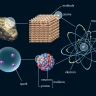
atome
(latin atomus, du grec atomos, qu'on ne peut couper)
Constituant fondamental de la matière dont les mouvements et les combinaisons rendent compte de l'essentiel des propriétés macroscopiques de celle-ci. (Un corps constitué d'atomes de même espèce est appelé corps simple ou élément chimique.)
PHYSIQUE ET CHIMIE
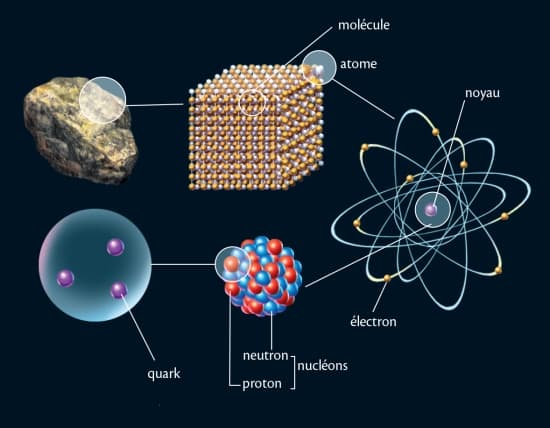
Le mot « atome » est aujourd'hui un paradoxe scientifique : en effet, les Grecs avaient désigné par ce terme, qui veut dire « indivisible », le plus petit élément, simple et stable, de la matière ; or on sait à présent qu’un atome est composé de particules plus petites : des électrons, des protons et des neutrons. Les protons et les neutrons, appelés nucléons, forment le noyau de l’atome et sont eux-mêmes composés de particules encore plus élémentaires : les quarks. La connaissance de cette structure ultime de la matière est à l’origine d’une révolution tant dans le domaine de la connaissance que dans celui des rapports entre les peuples (la fission de noyaux atomiques étant à la base des armes nucléaires).
1. Description d'un atome

Les atomes sont les plus petites parcelles d'un élément chimique qui puissent être conçues : ils sont constitués d'un noyau chargé positivement autour duquel gravitent des électrons chargés négativement, l'ensemble étant électriquement neutre.

Les ions dérivent des atomes par la perte ou par le gain d'un ou de plusieurs électrons : il existe des ions positifs (cations), qui résultent d'une perte d'électrons, et des ions négatifs (anions), qui résultent d'un gain d'électrons.
Les électrons ainsi impliqués sont situés à la partie la plus externe des atomes, qui est seule perturbée par un gain ou une perte d'électrons. Seuls ces électrons (électrons de valence) interviennent dans les réactions chimiques. Ces dernières se distinguent donc fondamentalement des phénomènes qui se produisent lors de l'explosion d'une bombe atomique, lesquels se situent au niveau du noyau. Les transformations intervenant au niveau nucléaire mettent en jeu une énergie (→ énergie nucléaire) un million de fois plus élevée que celle que libère une réaction chimique (→ énergie chimique).
En première approximation, on peut considérer qu'un atome occupe une partie de l'espace, de forme sphérique, d'un diamètre de quelques angströms (1 Å = 10−10 m).
1.1. La structure interne des atomes
L'étude de la structure interne des atomes a montré que tous, quel que soit l'élément qu'ils constituent, sont formés de trois espèces de particules élémentaires : les électrons, les protons et les neutrons.
Les électrons sont des particules légères de charge électrique négative, toutes identiques, qui se meuvent à grande vitesse dans le champ d'attraction du noyau chargé positivement.
D'un diamètre très petit par rapport à celui de l'atome, le noyau – dans lequel presque toute la masse est concentrée – est composé de particules appelées nucléons.
Les nucléons sont de deux espèces : les protons, possédant une charge électrique positive, égale en valeur absolue à la charge des électrons, et les neutrons, électriquement neutres.
Les propriétés d'un atome sont déterminées par le nombre d'électrons présents autour du noyau : ce nombre est égal au nombre Z de protons contenus dans ce noyau.
Les propriétés ne dépendent pas, pour l'essentiel, du nombre N de neutrons : les atomes d'un même élément peuvent contenir un nombre variable de neutrons. Les atomes d'un élément qui contiennent un nombre différent de neutrons constituent des isotopes de cet élément. En général, il existe plusieurs isotopes d'un même élément.
Z représente le nombre atomique ou numéro atomique de l'élément.
La somme Z + N = A est le nombre de masse du noyau.
Pour distinguer les isotopes d'un élément, on les désigne par leur symbole précédé des nombres A et Z qui lui sont propres : ainsi, 146C désigne l'isotope de carbone dont l'atome possède 14 nucléons (6 protons et 8 neutrons).
1.2. Quelques ordres de grandeurs
La masse de l'atome est de l'ordre de 10−26 kg. Un atome peut être assimilé à une sphère dont le rayon, variable d'un élément à l'autre, est de l'ordre de 10−10 m (soit 1 Å).
L'électron porte une charge élémentaire − e (e = 1,602 × 10−19 C), pour une masse m de 9,1093897 × 10−31 kg ou de 5,4 × 10−4 u en unité de masse atomique (1 u = 1,6605402 × 10−27 kg).
Il existe donc un rapport de 1 à 10 000 entre la masse de l'atome et celle de l'électron : dans un atome, la masse des électrons apparaît donc comme négligeable comparée à la masse du noyau.
La masse du proton est de 1,6726231 u (mp = 1,673 × 10−27 kg), et celle du neutron est de 1,6749286 u (mn = 1,675 × 10−27 kg).

Assimilé à une sphère, le volume du noyau est à peu près proportionnel au nombre de nucléons A : le rayon du noyau est, selon une formule empirique, proche de la racine cubique de A, r ≈ 1,41 × 10−15 × A1/3 m (de l'ordre de 10−15 m), ce qui correspond à 1 fm (femtomètre ou fermi).
Un facteur de 100 000 existe entre le rayon de l'atome et celui du noyau, et, si l'on néglige la masse des électrons, le noyau a une densité 10−15 fois plus élevée que celle de l'atome, ce qui correspond à une concentration énorme de matière. La même concentration appliquée à la masse totale de la Terre ramènerait notre planète à une sphère de 60 m de rayon.
1.3. Les atomes isolés
Les rares atomes isolés se rencontrent sous forme de gaz.
Les gaz rares (argon, hélium, krypton, néon, xénon) sont un exemple de la présence d'atomes isolés dans la nature : ils sont en très faible proportion dans l'air, où l'on trouve essentiellement de l'azote (78,084 %) et de l'oxygène (20,946 %) sous forme de molécules diatomiques (N2 et O2), du dioxyde de carbone et de la vapeur d'eau également sous forme de molécules.
Les gaz rares, qui ont été découverts par le chimiste britannique William Ramsay entre 1894 et 1898, ne représentent que 1 % du volume de l'air : argon 0,934 % ; hélium 0,52 × 10−3 % ; krypton 0,11 × 10−3 % ; néon 1,8 × 10−3 % ; xénon 8,7 × 10−6 %.
L'existence d'atomes libres de gaz rares résulte de leur configuration particulièrement stable : les ions se forment d'ailleurs à partir des atomes de telle sorte que, en général, la perte ou le gain d'électrons leur permette d'acquérir une configuration électronique d'atome de gaz rare.
1.4. Les atomes naturels et artificiels
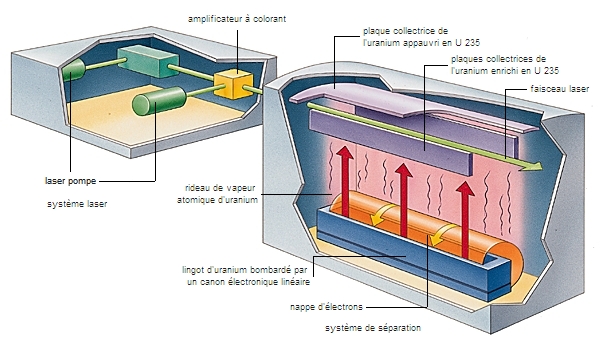
Outre les éléments identifiés dans la nature, et leurs isotopes naturels, on connaît aujourd'hui des éléments plus lourds que l'uranium (le plus lourd des éléments existant à l'état naturel, répertorié avec le numéro atomique 92), et de nouveaux isotopes d'éléments qui existent, en revanche, à l'état artificiel.
Les atomes de ces éléments, ou de ces isotopes, sont fabriqués artificiellement en faisant intervenir des réactions nucléaires, qui consistent à bombarder, par des particules variées et animées d'une très grande vitesse, les noyaux des atomes d'éléments connus.
Ces réactions permettent d'accroître le nombre Z de protons du noyau (et on obtient des atomes plus lourds que ceux de l'élément bombardé) ou de modifier le nombre N de neutrons (et on obtient des isotopes nouveaux).
En règle générale, les éléments artificiels ainsi obtenus sont radioactifs : leurs noyaux se désintègrent rapidement, et leur durée de vie peut donc être très brève, ce qui explique leur absence dans les milieux naturels. Les atomes artificiels d'éléments plus lourds que l'uranium (appelés transuraniens ou éléments superlourds) sont obtenus à partir de noyaux naturels d'uranium ou de thorium. Le premier d'entre eux, dans la séquence des numéros atomiques, est le neptunium, qui porte le numéro Z = 93 ; puis le plutonium (Z = 94), synthétisé en 1940, etc. Le bombardement de l'uranium par des particules chargées et accélérées dans des cyclotrons a ainsi permis d'obtenir de nombreux éléments transuraniens. Les éléments artificiels ainsi fabriqués ont une durée de vie de plus en plus courte à mesure que leur numéro atomique est plus grand.
On peut également fabriquer des isotopes, le plus souvent radioactifs, d'éléments connus, en soumettant les atomes d'éléments naturels à un bombardement de particules accélérées ou à l'action des neutrons émis par une pile atomique. Ces isotopes sont utilisés soit en médecine, notamment pour le traitement du cancer (bombe au cobalt) ou pour réaliser des diagnostics (radio-iode), soit en analyse chimique pour identifier et doser des éléments présents en très petites quantités (de l'ordre de la partie par million), soit en mécanique pour radiographier des pièces de grandes dimensions.
2. Historique de la notion d'atome

La constitution de la matière a très tôt préoccupé les philosophes. L'atomisme, où l'atome est l'« essence de toutes choses », constituant ultime et indivisible de la matière, tel que le concevaient dans l'Antiquité des philosophes comme Empédocle, Leucippe et Démocrite, et tel qu'il fut repris par Épicure et Lucrèce, ne pouvait guère dépasser la vision mécaniste de particules se combinant pour former des corps, à la suite d'une légère et aléatoire modification de leur trajectoire dans le vide (c'est le phénomène du clinamen, chez Épicure). Les philosophes observaient surtout ce qui les entourait et tombait immédiatement sous leurs sens : d'où la suprématie du concept des quatre éléments (l'air, l'eau, la terre, le feu) énoncé par Homère, repris par Thalès et conforté par Aristote, et qui perdurera jusqu'au xviiie s. C'est la chimie qui, 2 500 ans environ après les philosophes grecs, établira la notion moderne d'atome.
2.1. Vingt-trois siècles de tâtonnements
L'alchimie est pratiquée dès la plus haute Antiquité dans les grandes civilisations orientales, notamment en Chine et en Inde, où elle est appelée « science des saveurs » ou « science des élixirs ». En Occident, elle fleurit dans le monde hellénistique et sera transmise par les Arabes au monde chrétien.
2.1.1. Au Moyen Âge
Au Moyen Âge les alchimistes classent les substances en fumées, esprits, eaux, huiles, laines, cristaux… Mais ils cherchent moins à identifier des corps différents qu'à découvrir la réalité « philosophale » fondamentale cachée derrière les apparences. États et propriétés physiques dominent ces classifications, et du ixe au xvie s. s'ajoutent trois autres éléments : le mercure pour l'état métallique et l'état liquide, le soufre pour la combustion et le sel pour la solubilité (ces éléments sont dits « philosophiques » pour ne pas les confondre avec les corps du même nom).
2.1.2. La théorie du phlogistique

Au xviie s. apparaît avec l'Allemand Georg Ernst Stahl la théorie du phlogistique : fluide miracle associé à tous les corps, il s'ajoute, se retranche, et permet d'expliquer le processus de combustion. Cependant, la chimie moderne est amorcée par le Français Jean Rey qui reconnaît, dès 1630, la conservation de la masse dans les transformations chimiques et le rôle de l'air dans les combustions. L'Irlandais Robert Boyle, dès 1661, fait la distinction entre mélanges et combinaisons chimiques.
2.1.3. La chimie devient une science

Au xviiie s., la chimie devient une véritable science avec le Britannique Joseph Priestley et le Français Antoine Laurent de Lavoisier qui imposent, par des méthodes dignes de la recherche actuelle, de nouvelles règles de nomenclature permettant de comprendre le processus des combinaisons chimiques. Lavoisier définit l'élément chimique, qui ne peut pas être décomposé en substances plus simples par la chaleur ou par une réaction chimique, ainsi que le composé, qui est la combinaison de deux éléments, ou plus, dans une proportion de poids déterminée.
2.2. L'approche de la connaissance actuelle de l'atome
2.2.1. La théorie atomique de Dalton
La première théorie moderne sur l'atome est énoncée, en 1808, par le Britannique John Dalton : tous les atomes d'un même corps simple, autrement dit d'un même élément, sont identiques, mais diffèrent des atomes d'autres éléments par leur dimension, leur poids et d'autres propriétés. Il donne d'ailleurs une liste de poids relatifs, par rapport à l'hydrogène, de quelques atomes (azote, carbone, oxygène, etc.).
2.2.2. Atome et tableau périodique des éléments

En 1869, le Russe Dimitri Ivanovitch Mendeleïev publie le premier tableau périodique des éléments classés en fonction de leur poids atomique. Il démontre que les propriétés chimiques des éléments sont des fonctions périodiques de leur « poids ». Pour cela, il est conduit, d'une part, à inverser certaines positions dans le classement (inversions qui s'avéreront, par la suite, en accord avec le fait que presque tous les éléments chimiques sont des mélanges de plusieurs isotopes) et, d'autre part, à laisser des cases vides correspondant, selon lui, à des éléments non encore découverts, mais dont il prévoit l'existence et les propriétés chimiques.
2.3. Découvertes des constituants de l'atome
Il faut attendre la fin du xixe s., avec les premières découvertes sur les constituants de l'atome, pour que la matière livre ses premiers secrets.
2.3.1. L'électron

.En 1891, l'Irlandais George Johnstone Stoney propose le nom d'électron pour désigner une particule qui porterait une charge électrique élémentaire négative. Mais c'est l'étude des rayons cathodiques par le Français Jean Perrin et par le Britannique Joseph John Thomson qui permet, en 1897, la découverte de l'électron, particule chargée négativement. J. Thomson mesure la charge e de l'électron par rapport à sa masse. La valeur de cette charge (− 1,6 × 10−19 C) est précisée, à 1 % près, en 1911, par l'Américain Robert Andrews Millikan.
2.3.2. La radioactivité et les nucléons

L'observation en 1896 par Henri Becquerel d'un rayonnement inconnu, les mystérieux « rayons uraniques », excite la curiosité de nombreux chercheurs. En effet, les sels d'uranium émettent un rayonnement capable de rendre l'air conducteur d'électricité, d'impressionner une plaque photographique, et qui est aussi pénétrant que les rayons X.
Les radioéléments

À partir de cette observation, Marie Curie commence, en 1898, ses recherches sur la pechblende (oxyde naturel d'uranium) ; son but est de quantifier le rayonnement émis en mesurant l'intensité du courant d'« ionisation » qui est établi dans l'air, sous son action. Elle montre que l'intensité de ce rayonnement est proportionnelle à la quantité d'uranium présent, et elle retrouve ce même phénomène avec l'étude du thorium. Elle propose d'appeler radioactivité cette propriété, et substances radioactives les corps émetteurs de ce rayonnement.
Puis, en collaboration avec Pierre Curie, elle découvre d'autres radioéléments beaucoup plus radioactifs que l'uranium : le polonium en juillet 1898 et le radium en décembre de la même année. Les sources de radium sont un million de fois plus radioactives que les sels d'uranium. Dès ce moment, les découvertes de nouveaux éléments radioactifs se succèdent ; ainsi, André Louis Debierne isole l'actinium en 1899.
Le rayonnement radioactif

L'étude du rayonnement radioactif, émetteur de particules, peut alors être entreprise. Les physiciens reconnaissent deux espèces de rayonnements, que le Britannique Ernest Rutherford désigne par les lettres grecques α et β – par la suite un troisième rayonnement, γ (→ rayons gamma), sera identifié –, qui se distinguent par leur aptitude à pénétrer la matière et par leur comportement sous l'action d'un champ magnétique ou électrique. En 1903, ses compatriotes W. Ramsay et F. Soddy montrent que le rayonnement α est formé de noyaux d'hélium, projetés à grande vitesse.
2.3.3. Le noyau
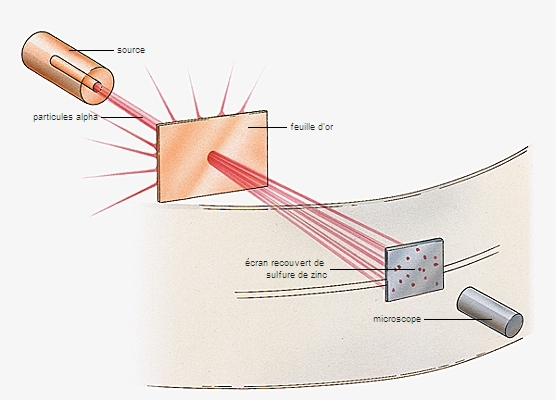
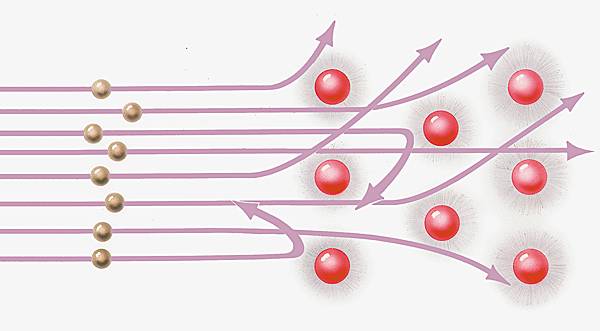
L'existence du noyau est démontrée en 1907 par Rutherford, qui a l'idée de bombarder la matière, afin de mieux comprendre sa nature, à l'aide de particules α utilisées comme de véritables projectiles. À cet effet, il réalise, dans un tube sous vide, un faisceau étroit de particules α émises par désintégration radioactive du polonium, et place sur son trajet une feuille d'or très mince. Il constate que la plupart des particules n'ont pas rencontré d'obstacles en traversant la feuille d'or, et que par conséquent la matière est pratiquement vide. Cependant, quelques particules sont fortement déviées, et le calcul montre qu'elles ne peuvent être repoussées que par des charges positives concentrées dans un très petit volume.
2.3.4. Le proton
Un des élèves de Rutherford, H. G. Jeffreys Moseley, détermine en 1913 le nombre de charges électriques unitaires et positives que contient l'atome (numéro atomique Z), tandis que son maître découvre, en 1919, la particule positive constitutive du noyau, qu'il nomme proton. Il pressent l'existence d'une particule semblable mais neutre.
2.3.5. Le neutron
En 1930, les Allemands Walter Bothe et Heinrich Becker observent, en bombardant des éléments légers (lithium, béryllium, bore) par des particules α, l'apparition d'un nouveau rayonnement encore plus pénétrant que les protons, qui n'est pas dévié par un champ électrique ou magnétique. C'est encore un élève de Rutherford, James Chadwick, qui en 1932 montre que ce rayonnement est constitué de particules de masse quasi identique à celle du proton, mais neutres, insensibles aux charges électriques, et donc très pénétrantes : les neutrons.
2.3.6. Mésons et quarks
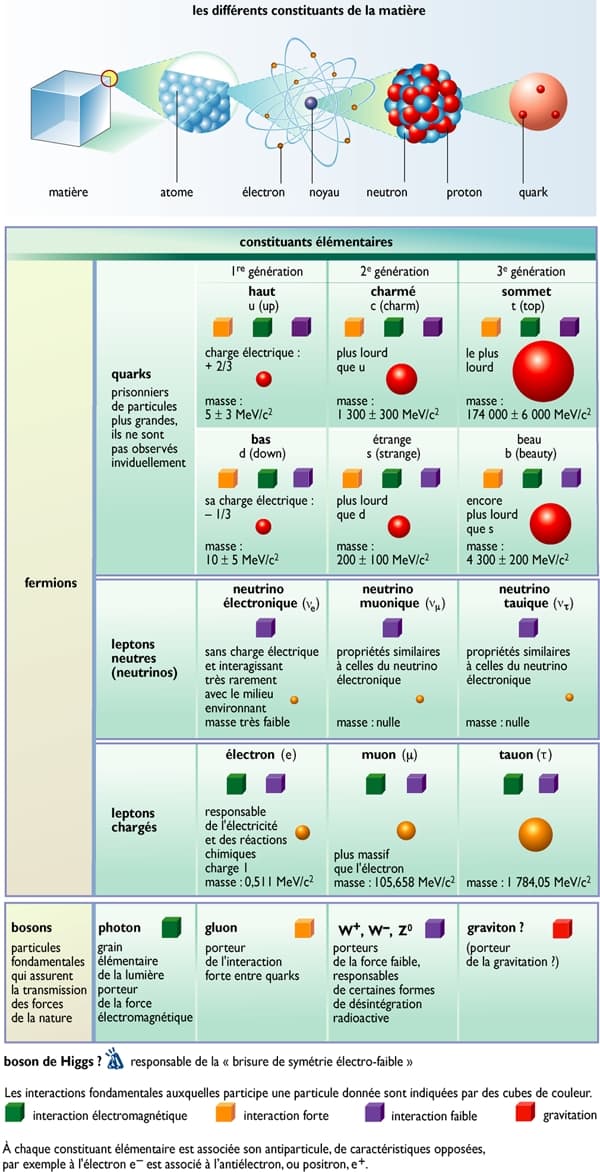
Par la suite, on s'aperçoit que les nucléons (neutrons et protons) ne restent pas inertes dans le noyau : ils interagissent en échangeant des particules plus élémentaires, les mésons π (ou pions), découverts en 1947 par le Japonais Yukawa Hideki et le Britannique Cecil Frank Powell.
Dans les années 1960, l'Américain Murray Gell-Mann introduit l'hypothèse que les nucléons sont eux-mêmes composés de trois grains quasi ponctuels, les quarks, liés par des gluons. Avec l'avancée des constructions théoriques pour rendre compte des faits expérimentaux, le nombre des quarks a été porté à six. Ainsi, en moins d'un siècle, la notion de particule élémentaire est passée de la molécule à l'atome, puis au noyau, ensuite au nucléon puis au quark, et d’autres particules théoriques sont encore à l’étude dans les gigantesques accélérateurs.
3. La représentation de l'atome
Dès que la notion scientifique d'atome apparut, il s'avéra nécessaire de la symboliser pour parvenir à une meilleure compréhension des processus chimiques.
3.1. La représentation symbolique de l'atome

Bien que les termes d'atome et d'élément y soient parfois confondus avec celui de molécule, la première tentative de représentation de l'atome peut être attribuée à John Dalton, qui donne une table des « poids » des différents éléments connus : ces derniers sont représentés par des cercles dans lesquels des lettres, des points ou des traits caractérisent la nature de l'élément. À la même époque, en 1814, la première notation systématique des éléments par le Suédois Jöns Jacob Berzelius annonce la représentation qui sera retenue par la suite. Chaque élément chimique est représenté par un symbole : la première lettre du nom en latin suivi éventuellement d'une deuxième lettre pour distinguer des éléments ayant des initiales identiques. Ainsi, le fluor (F) se distingue du fer (Fe), du fermium (Fm), ou du francium (Fr).
3.2. La représentation spatiale ou la notion de modèle
Dès les premiers résultats expérimentaux, les physiciens entreprennent de proposer une représentation de l'atome capable d'intégrer dans un ensemble cohérent les observations fragmentaires. Ils vont ainsi élaborer un modèle qui rend compte à un instant donné de la totalité des informations recueillies et validées.
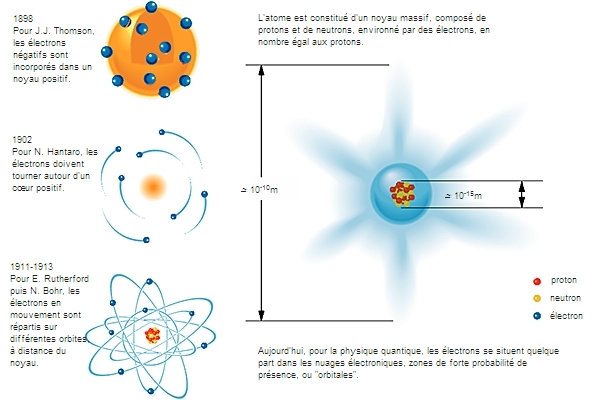
3.2.1. Le modèle planétaire
En 1901, Jean Perrin propose une représentation planétaire de l'atome où l'électron décrit une trajectoire circulaire autour du noyau. Reprise et mise en équation par le Danois Niels Bohr en 1913, cette interprétation va s'installer durablement dans les esprits, alors que dès 1927 de nouvelles découvertes la mettent en cause.
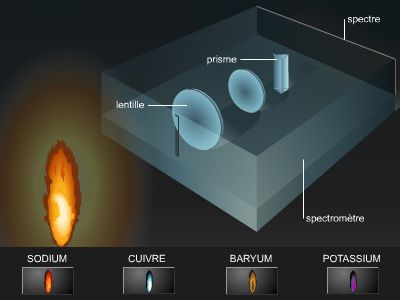
Ce modèle s'impose au début du xxe s., car il concilie des résultats provenant d'horizons divers. En effet, on a observé, dès 1850, que chaque gaz, quand il est excité par des décharges électriques, émet une lumière qui, en passant dans un spectroscope à prisme, donne un spectre d'émission différent. Même l'hydrogène, l'élément le plus simple, donne naissance à un spectre complexe.
À la suite des travaux du Suisse Johann Jakob Balmer, en 1885, sur le spectre d'émission de l'hydrogène, le Suédois Johannes Robert Rydberg a proposé une relation mathématique simple entre les longueurs d'onde λ des raies caractéristiques du spectre de l'hydrogène :
1/λ = RH (1/n12 − 1/n22).
• RH est une constante spectroscopique appelée constante de Rydberg (RH = 109 737,32 cm−1) ;
• 1/λ est l'inverse de la longueur d'onde, appelé nombre d'onde (exprimé en cm−1) ;
• n1 et n2 sont des nombres entiers tels que n2 > n1, une série de raies du spectre de l'hydrogène étant caractérisée par une valeur donnée de n1, et par des valeurs de n2 égales à n1 + 1, n1 + 2, n1 + 3.
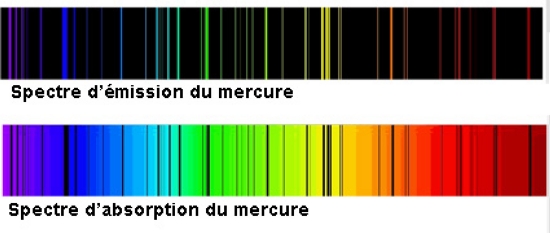
En 1913, James Franck et l'Allemand Gustav Hertz démontrent qu'un atome ne peut absorber de l'énergie que par quantités discrètes (ΔE) : ce phénomène donne naissance à un spectre d'absorption. Réciproquement, une perte de ces quantités d'énergie (ΔE) engendre une radiation (→ rayonnement) dont la fréquence (ν) émise vérifie la relation avancée par un autre Allemand, Max Planck, pour définir un quantum d'énergie :
ν = ΔE/h
dans laquelle h est la constante de Planck (h = 6,626 × 10−34 J . s).
Ces propositions sont corroborées par le calcul qui mène à la valeur expérimentale de la constante de Rydberg.
Ainsi, il apparaît que l'ensemble des travaux menant à la quantification des niveaux d'énergie des électrons dans l'atome s'accorde avec le phénomène de discontinuité des spectres d'émission de l'atome d'hydrogène : c'est la raison de la faveur du modèle de Bohr.
Selon ce modèle, les électrons se déplacent autour du noyau central sur des orbites analogues à celles que parcourent les planètes autour d'un astre. Au centre se trouve le noyau, chargé positivement, autour duquel gravitent les électrons négatifs ; la charge du noyau est égale à la valeur absolue de la somme des charges des électrons.
Ces électrons planétaires ne peuvent se situer que sur certaines orbites stables, associées chacune à un niveau d'énergie formant une suite discontinue, et correspondant aux différentes couches désignées par les lettres K, L, M, N, etc. On dit que l'énergie de l'atome est quantifiée.
La couche électronique K, la plus proche du noyau, peut au plus contenir deux électrons, et la couche L, huit électrons. Sous l'effet d'une excitation extérieure, l'électron peut passer d'une orbite à une autre, d'énergie supérieure. Mais il revient ensuite spontanément sur des orbites d'énergie inférieure. C'est alors qu'il rayonne de l'énergie.
3.2.2. Limites du modèle planétaire
En dépit du perfectionnement du modèle de Bohr, en 1928, par l'Allemand Arnold Sommerfeld, qui propose pour l'électron une trajectoire elliptique, une rotation sur lui-même (spin de l'électron) et la quantification étendue à l'espace pour tenter de rendre compte de la décomposition des raies spectrales émises quand on place l'atome dans un champ magnétique (effet Zeeman, du Néerlandais Pieter Zeeman), ce modèle avait des difficultés à interpréter les résultats obtenus pour les atomes à plusieurs électrons.
De plus, l'électron, qui rayonne de l'énergie, devait logiquement tomber sur le noyau.
Malgré le succès remporté par le modèle atomique de Bohr, il est très vite apparu impossible de développer une théorie générale pour tous les phénomènes atomiques en surimposant simplement aux principes de la mécanique classique ceux de la mécanique quantique.
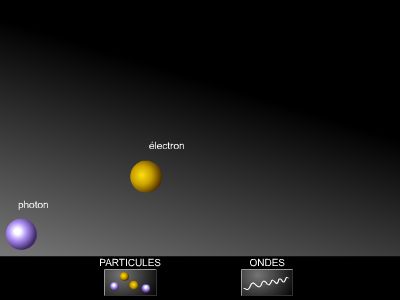
3.2.3. Dualité onde-corpuscule
Vers 1900, Max Planck avait associé au caractère ondulatoire du rayonnement défini par une longueur d'onde λ un caractère corpusculaire sous forme de photons dont l'énergie E est liée à cette longueur d'onde λ par la relation (où c est la vitesse de la lumière) :
E = hν = hc/λ.
Le Français Louis de Broglie extrapole cette théorie des photons à toute particule, dans sa thèse en 1924, où il montre que les propriétés corpusculaires des électrons ont une contrepartie ondulatoire.
Dès 1927, les Américains Clinton Joseph Davisson et Lester Halbert Germer prouvent le bien-fondé de cette relation en réalisant la diffraction d'électrons par un cristal, démontrant ainsi le caractère ondulatoire des électrons (en 1978, on réalisera aussi la diffraction de l’antiparticule de l’électron nommée positon, découvert en 1932 par l'Américain Carl David Anderson).
Par ailleurs, en 1927, l'Allemand Werner Heisenberg traduit par une inégalité l'impossibilité de connaître simultanément deux paramètres pour une particule en mouvement (vitesse et position, par exemple). C'est le principe d'incertitude, incompatible avec le modèle de Bohr :
Δp × Δx > h
où Δp et Δx expriment respectivement les incertitudes sur les paramètres p (quantité de mouvement) et x (position).
3.3. L'atome en mécanique ondulatoire
Le caractère double de la matière, ondulatoire et corpusculaire, et le principe d'incertitude font abandonner le modèle de Bohr et sa représentation ponctuelle de l'électron parcourant une trajectoire. Une démarche neuve apparaît avec des modes de raisonnement et de calcul qui lui sont propres. La position, la vitesse et la direction du déplacement d'un électron ne pouvant être définies simultanément, on détermine la probabilité de sa présence dans un certain volume de l'espace situé autour du noyau, que l'on appelle orbitale ou nuage électronique. On lui associe une fonction complexe purement mathématique nommée fonction d'onde (Ψ), qui se calcule par la résolution d'une équation posée par l'Autrichien Erwin Schrödinger.

L'application de l'équation de Schrödinger à l'électron unique de l'atome d'hydrogène dans son état de plus faible énergie, appelé état fondamental, permet de retrouver les résultats expérimentaux déjà interprétés par le modèle planétaire. Mais elle intègre les états inhabituels, dits états excités, où les énergies sont plus élevées que dans le cas de l'état fondamental, et permet l'extension et la généralisation du modèle aux atomes autres que l'hydrogène : les électrons de ces derniers occupent, à l'état fondamental, des orbitales comparables à celles des états excités de l'atome d'hydrogène.

Pour rendre compte du comportement des atomes possédant un seul électron sous l'effet d'un champ magnétique ou d'un champ électrique, on a été amené à introduire la notion de spin, qui trouve sa formulation mathématique grâce au Britannique Paul Dirac (en première approximation par rapport à la mécanique classique, le spin traduit un mouvement propre de rotation de l'électron sur lui-même).
On déduit par ailleurs de la mécanique ondulatoire le principe dit d'exclusion de Pauli, selon lequel deux électrons d'un même atome ne peuvent pas être repérés par le même ensemble de nombres quantiques n, l, m, s.
Il apparaît en outre que les électrons sont généralement localisés plus particulièrement dans certaines directions de l'espace autour du noyau.
3.4. Paramètres caractéristiques des électrons dans l'atome

La résolution mathématique de l'équation de Schrödinger impose des restrictions qui conduisent à l'introduction de nombres appelés nombres quantiques – n, l, m, s – devant satisfaire à certaines conditions ; l'énergie et la localisation spatiale des électrons gravitant autour du noyau sont déterminées par ces nombres .
3.4.1. Le nombre quantique principal
Le nombre quantique principal n est un entier strictement positif : il se nomme nombre quantique principal, car il quantifie l'énergie. On retrouve par la mécanique ondulatoire la même expression des différents niveaux d'énergie de l'atome d'hydrogène que celle obtenue dans le modèle de Bohr soit :
En = −13,6/n2 en eV (1 eV = 1,6 × 10−19 J)
avec n = 1, 2, 3…
Le nombre n détermine également le volume à l'intérieur duquel l'électron a le plus de chance de se trouver : quand n croît, le volume augmente. Les valeurs successives 1, 2, 3, etc. correspondent à l'ancienne notation des couches atomiques par les lettres K, L, M, etc.
Cependant, pour décrire une orbitale atomique, le nombre quantique principal n n'est pas suffisant, car si l'énergie fixe la taille de l'orbitale, elle ne donne pas la direction de l'espace où la probabilité de trouver l'électron est importante.
3.4.2. Le nombre quantique azimutal
Le nombre l est un entier positif, strictement inférieur à n, appelé nombre quantique azimutal, ou nombre quantique secondaire (par exemple, si n = 2 alors l = 0 ou 1) ; l quantifie le module du moment cinétique orbital.
De plus, l détermine la forme de l'orbitale dont les grands axes indiquent la direction où l'on a le plus de chance de trouver l'électron. Selon que l = 0, 1, 2, 3 ou 4, les différents types d'orbitales atomiques sont désignés respectivement par s, p, d, f ou g.
Ainsi, pour l = 0, la distribution électronique est symétrique autour du noyau et la probabilité de trouver l'électron est la même dans toutes les directions ; c'est le cas de l'hydrogène à l'état fondamental.
Si l = 1 ou 2 (orbitales p ou d), la fonction d'onde présente des « excroissances » dans des directions privilégiées de l'espace, justifiant l'orientation et les valeurs précises des angles de liaison des atomes entre eux dans les molécules.
3.4.3. Le nombre quantique magnétique
Le nombre m est un entier variant de − l à + l, prenant donc 2l + 1 valeurs : on l'appelle nombre quantique magnétique, car il quantifie la projection du moment cinétique sur un axe privilégié, celui selon lequel on applique un champ magnétique.
Ainsi, pour n = 2 :
• à l = 0 correspond m = 0 ;
• à l = 1 correspond m = − 1, 0, + 1,
m indique donc le nombre d'orbitales.
Pour l = 1 on a des orbitales p, où la probabilité de trouver l'électron est importante sur l'axe Oz pour m = 0, et suivant les axes Oy ou Ox pour m = − 1 ou + 1. À chaque type d'orbitale atomique (s, p) correspondent donc (2l + 1) orbitales atomiques, soit 1 de type s, 3 de type p, 5 de type d, 7 de type f, qui ont chacune une forme et une orientation bien particulières.
Ψn, l, m est la fonction d'onde qui exprime la forme de l'orbitale atomique occupée par un électron ; cette fonction au carré Ψ2n, l, m exprime la probabilité de présence de cet électron dans les différents domaines de l'espace.
(Ψn, l, m est une fonction des coordonnées de l'espace : x, y, z en coordonnées cartésiennes, ou r, θ, φ en coordonnées polaires.)
3.4.4. Le spin
Le quatrième nombre quantique est le spin s, qui prend deux valeurs opposées (+ 1/2 et − 1/2) pour chaque ensemble n, l, m.
Aucun électron d'un même atome n'a ses quatre nombres quantiques identiques à ceux d'un autre électron (principe d'exclusion). Pour une valeur n du nombre quantique principal le nombre maximum d'électrons est 2n2.
La résolution de l'équation de Schrödinger n'est rigoureuse que pour l'atome d'hydrogène. Elle s'étend toutefois aisément aux ions hydrogénoïdes, tels que He+ (un seul électron autour du noyau), et avec des approximations satisfaisantes elle s'applique aux atomes à plusieurs électrons.
Jusqu'à présent, l'hypothèse quantique, tout en se modifiant au fur et à mesure des nouvelles données, permet d'expliquer l'ensemble des connaissances.
À partir du nombre global d'électrons, et en jouant avec les valeurs que peuvent prendre entre eux les nombres quantiques, il est possible de construire la carte d'identité de chaque atome tout en respectant les règles qui, parfois sous des noms différents, ne sont qu'une même expression du fait que l'énergie la plus faible confère à l'édifice la stabilité la plus grande.