gaz
(mot forgé d'après latin chaos)

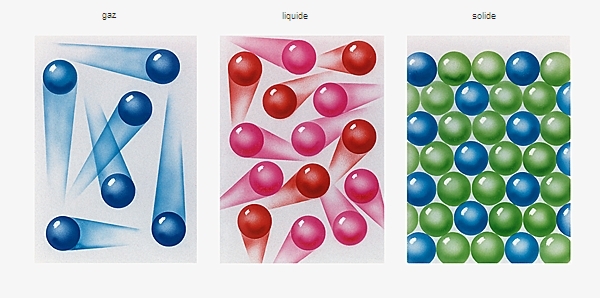
État physique de la matière dans lequel les molécules sont peu liées et animées de mouvements désordonnés (agitation thermique).
PHYSIQUE
La plupart des composés sont à l'état gazeux à haute température (ou à basse pression). Lorsqu'on abaisse la température (et/ou qu'on augmente la pression), ils passent à l'état liquide (→ liquéfaction), puis à l’état solide (→ solidification).
Ces changements d'état sont réversibles. La température de transition entre deux états est fixe et caractérise un corps pur donné.

Contrairement aux solides et aux liquides qui sont difficiles à comprimer (→ compressibilité), les gaz se dilatent librement pour occuper tout le volume du récipient qui les contient. Ils ont une densité environ mille fois inférieure à celle des liquides et des solides.
Les interactions entre les molécules d’un gaz sont faibles : celles-ci se déplacent suivant des trajectoires rectilignes qui changent de direction à chaque collision avec une autre molécule. La gaz conduisent peu la chaleur et l'électricité, sauf si on les ionise (formation d'un plasma).
Les propriétés macroscopiques d'un gaz se déduisent donc directement des propriétés des molécules qui le composent (ou des atomes dans le cas d'un gaz monoatomique). En particulier, les gaz présentent des raies d’émission et d'absorption (→ spectre) caractéristiques des molécules (ou atomes) les constituant, ce qui permet de les identifier (spectroscopie).
1. Théorie cinétique des gaz
La théorie cinétique des gaz a pour but d'expliquer les propriétés macroscopiques des gaz − pression (P), volume (V) et température (T) − en appliquant les lois de la mécanique statistique au mouvement des molécules de gaz.
Le volume d'un gaz reflète la distribution dans l'espace de ses molécules.
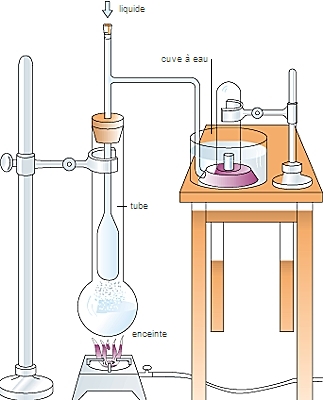
La pression du gaz, que l'on peut mesurer à l'aide de jauges placées sur les parois du récipient, représente en moyenne les changements du moment cinétique des molécules après une collision.
La température du gaz est proportionnelle à l'énergie cinétique moyenne de ses molécules, c’est-à-dire au carré de la vitesse moyenne des molécules (plus la température est élevée, plus la vitesse moyenne des particules est élevée).
La réduction de ces mesures macroscopiques aux variables mécaniques − telles que la position, la vitesse, le moment et l'énergie cinétiques des molécules − qui sont soumises aux lois de la mécanique de Newton, permet de générer la plupart des lois empiriques sur les gaz. Cette partie de la physique, qui s'efforce de mettre en relation les propriétés des gaz et la mécanique classique, constitue la théorie cinétique des gaz. D'une part, cette théorie fournit une base pour l'équation d'état des gaz parfaits ; d'autre part, elle permet de déterminer de nombreuses autres propriétés des gaz, comme par exemple la distribution statistique de la vitesse des molécules et les propriétés de transfert telles que la conductivité thermique, le coefficient de diffusion ou la viscosité.
2. Gaz parfaits
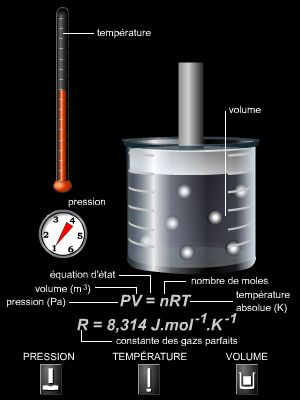
Un gaz parfait est un modèle de gaz pour lequel on néglige les interactions moléculaires du gaz (à l’exception des collisions) et dont le volume propre est négligeable devant le volume du récipient. Ainsi, les propriétés d'un gaz réel à basse pression (interactions faibles entre molécules) se rapprochent de celles d'un gaz parfait. On peut alors décrire le comportement du gaz par l'équation d'état des gaz parfaits :
PV = nRT
avec n le nombre de moles de gaz (en mol), P la pression du gaz (en pascals, Pa), V le volume (en m3) occupé par les n moles et T la température absolue du gaz (en kelvins, K) ; la constante R, appelée constante des gaz parfaits, vaut environ 8,31 J ∙ K– 1 ∙ mol– 1.
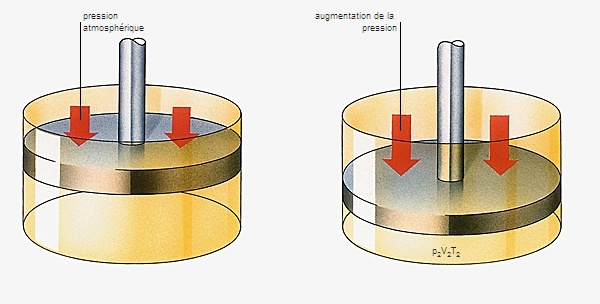
Cette équation montre que :
• à température constante, le volume d'un gaz est inversement proportionnel à sa pression (loi de Boyle-Mariotte) ;
• à pression constante, le volume est proportionnel à la température absolue du gaz (loi de Gay-Lussac) ;
• à volume constant, la pression du gaz est proportionnelle à sa température absolue (loi de Charles).
Par ailleurs, dans un mélange de gaz parfaits, la pression totale est égale à la somme des pressions partielles (loi de Dalton).
L'équation d'état du gaz parfait permet également de définir que, dans les conditions normales de température et de pression (T = 273,15 K et P = 1,013 × 105), un volume de 22,4 litres contient une mole de gaz. On retrouve aussi la relation entre la masse molaire M (→ mole) du gaz et sa densité d par rapport à l'air : M = 29d.
3. Gaz réels
L'équation d'état des gaz parfaits est approximative car valable uniquement aux basses pressions. Par conséquent, un gaz parfait ne peut pas se liquéfier, quels que soient le refroidissement et la compression auxquels il est soumis. Or, tous les gaz réels se liquéfient. Il convient donc d’adapter l'équation d'état des gaz parfaits aux cas réels à l’aide de l’équation d'état de Van der Waals donnée pour une mole de gaz :
(P + a/V2)(V – b) = RT
a et b étant des paramètres adaptables déterminés par des mesures expérimentales effectuées sur le gaz concerné ; ce sont des paramètres qui varient d'un gaz à un autre.
L'équation de Van der Waals peut également être interprétée au niveau microscopique : l’interaction entre molécules est fortement répulsive pour les molécules proches les unes des autres, mais elle devient légèrement attractive pour un éloignement moyen et disparaît lorsque l'éloignement est important. Ainsi, à basse pression, tous les gaz tendent à avoir un comportement de gaz parfait. Mais à pression élevée, la loi des gaz parfaits doit être rectifiée pour prendre en compte les forces attractives ou répulsives.
4. Changements d’état et applications industrielles
Aux basses températures (mouvement de molécules réduit) et aux pressions élevées (espaces intermoléculaires réduits), les molécules d'un gaz sont mutuellement soumises à l'influence de leurs forces d'attraction. Lorsque certaines conditions critiques sont réunies, le système tout entier passe à l'état liquide (liquéfaction ou condensation).
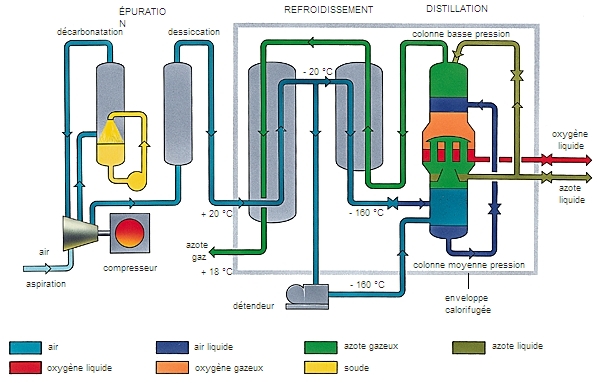
Le procédé de liquéfaction est très utilisé dans l’industrie chimique et frigorifique où de nombres gaz sont liquéfiés de manière à réduire leur volume et donc à faciliter leur transport et leur stockage.

Parmi les gaz les plus utilisés sous leur forme liquéfiée, on trouve l’hélium liquide (– 269 °C), l’azote liquide (– 196 °C), l’oxygène liquide (– 183 °C), le gaz naturel liquéfié (– 161 °C) et le gaz de pétrole liquéfié (constitué essentiellement de propane liquide à – 42 °C).