noyau atomique

Partie centrale de l'atome, autour de laquelle se meuvent les électrons.
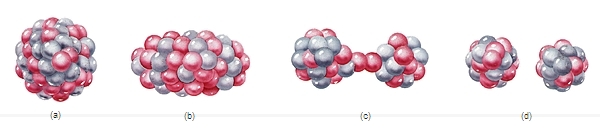
Depuis la découverte du neutron (1932), le noyau atomique est décrit comme un assemblage de (Z + N) nucléons : Z (nombre ou numéro atomique) protons et N neutrons. Sa charge électrique (+ Ze) est positive, sa masse est pratiquement celle de l'atome, et ses dimensions – environ 10 000 fois plus petites que celles de l'atome – sont de l'ordre de 10−13 cm. Le noyau d'un élément chimique est caractérisé par son numéro atomique Z, mais, pour une valeur donnée de Z, existent généralement divers isotopes plus ou moins stables, correspondant à des valeurs différentes de N.
La masse des noyaux n'est pas rigoureusement proportionnelle au nombre de masse A = Z + N. Selon la relation d'Einstein E = mc2, l'énergie de liaison du noyau correspond au défaut de masse observé. Une partie de cette énergie de liaison peut être libérée lors de la fission du noyau d'uranium ou lors de la fusion de nucléons pour former un noyau d'hélium. Malgré les divers modèles nucléaires proposés (modèle en couches, qui stipule que les nucléons se meuvent dans un potentiel central ;modèle de la goutte liquide, qui décrit le noyau comme un objet hydrodynamique), on ne possède pas encore de théorie quantitative du noyau. L'interaction entre les nucléons serait la résultante extérieure de l'interaction forte (mettant en jeu des quarks et des gluons), qui s'exerce à l'intérieur du nucléon lui-même (→ particules élémentaires).
On a pu déterminer de nombreuses propriétés globales, par exemple la densité, remarquablement semblable pour tous les noyaux ; la forme, où on observe une grande diversité, les noyaux étant, autour de certaines valeurs de N et de Z, tout à fait sphériques et devenant ailleurs fortement déformés, avec en général une forme d'ellipsoïde allongé ou aplati ou n'ayant parfois même plus de symétrie de révolution autour d'un axe.




