chimie
(latin médiéval chimia, du grec médiéval khêmeia)

Partie des sciences physiques qui étudie la constitution atomique et moléculaire de la matière et les interactions spécifiques de ses constituants.
Introduction
La chimie étudie la nature des substances matérielles et les transformations qui affectent cette nature. Une définition comme celle-ci n'a toutefois qu'une valeur très relative. La chimie peut être considérée de deux manières : il faut se placer tantôt au point de vue que l'on dira empirique, ou encore phénoménologique ; et tantôt au point de vue atomistique, ou structurel.
Telles que les choses se présentent à la perception sensible, la chimie s'occupe des corps. Elle laisse à la physique, dans une large mesure, la question de leur état (solide, liquide ou gazeux) ainsi que leurs caractéristiques quantitatives (densité, température de fusion, etc.) afin d'en étudier la nature intrinsèque. Elle se demande, par exemple, si telle substance est un acide ou bien une base. Si c'est un acide, elle cherche à préciser lequel. Elle examine en particulier les transformations qui s'opèrent lors d'une réaction : disparition de certaines substances et apparition d'autres. Dans cette aspect de recherche, la chimie empirique procède notamment par analyse : elle décompose.
La chimie considère, en outre, tous les corps comme constitués d'atomes. Ces derniers subsistent en général de manière groupée, en molécules notamment. Connaître la nature d'une substance consiste à savoir de quels atomes elle est constituée ainsi que leur mode de groupement. L'ozone, par exemple, qu'il soit ou non à l'état gazeux, est constitué de molécules, chacune d'entre elles comportant trois atomes d'oxygène. Dans cette perspective, l'étude des transformations qui se produisent au cours d'une réaction est celle des modifications qui s'opèrent dans les regroupements. On sait depuis Lavoisier que l'oxygène et l'hydrogène, en réagissant, se combinent pour donner de l'eau. La description atomiste de ce phénomène est que les atomes d'oxygène, au lieu de rester groupés deux par deux, en molécules de dioxygène pour être exact, se joignent chacun à une molécule de dihydrogène, elle-même constituée, comme son nom l'indique, de deux atomes d'hydrogène. Les nouvelles molécules ainsi constituées sont celles de l'eau, que celle-ci soit liquide, solide (glace) ou gazeuse (vapeur).
Historique
De l'alchimie à la chimie
La chimie a eu à se dégager de l'alchimie, qui lui a laissé le nom. Cette dernière cherchait depuis de nombreux siècles à maîtriser les puissances de la nature, y compris celles de la vie, et cela en un sens autant spirituel que matériel. Les expériences avaient certes une bonne part dans l'activité des alchimistes. Mais leurs conceptions, sans doute, les ont empêchés de trouver la bonne piste. Il fallait aborder la nature comme on a commencé de le faire au xviie s., c'est-à-dire dans l'esprit de la philosophie mécaniste. Il fallait séparer radicalement le matériel du spirituel. Dans le premier de ces domaines, il fallait même opérer un rejet aussi poussé que possible des qualités occultes et, enfin, y introduire le quantitatif. Il fallait aussi rejeter l'autorité d'Aristote, et prendre l'habitude d'exposer publiquement, avec précision, les observations et les démarches faites dans les expériences. Toutes ces conditions ne s'établirent que lentement. Dans les débuts de l'époque classique, d'ailleurs, on ne distingue guère le chimiste de l'alchimiste. Toutes sortes d'idées, qui plus tard seront abandonnées pour leur manque de valeur scientifique, ont encore cours, ou du moins donnent-elles lieu à discussion.

Durant les xviie et xviiie s., quelques premiers acquis solides furent obtenus. On précisa certaines catégories importantes, comme celle d'acide ; on tenta de fixer une nomenclature des corps ; on élabora une notion d'élément plus juste que celle qui avait été héritée de l'Antiquité. On en avait en effet retenu l'idée que toutes les choses étaient plus ou moins composées par le mélange de quelques natures fondamentales, comme l'eau, la terre, l'air et le feu. On doit à Robert Boyle (1627-1691) l'idée de réserver l'appellation d'« élément » pour ce qui résiste à toutes les tentatives de décomposition. La révolution industrielle naissante, en outre, imposait déjà ses premières exigences d'efficacité. L'acide sulfurique, par exemple, commençait à être produit hors des laboratoires.
L'essor de la chimie scientifique




Le changement prit une tournure décisive avec les travaux d'Antoine de Lavoisier (1743-1794). Celui-ci précisa les notions de corps simple et de combinaison. Mais, surtout, il pratiqua le premier la mesure systématique des « poids », autrement dit des masses. En collaboration avec Laplace, il fut aussi le premier à mesurer la chaleur qui se dégage lors des réactions. Pour ces raisons il est permis de voir en lui l'un des fondateurs de la chimie générale. Des lois fondamentales furent établies. Lavoisier avait affirmé le principe de conservation des masses : la masse totale des corps intervenant dans une réaction est égale à la masse totale des corps qu'elle produit. D'autres lois furent trouvées par John Dalton (1766-1844), Joseph Louis Proust (1754-1826) et Louis-Joseph Gay-Lussac (1778-1850). Elles mettaient en évidence que les grandeurs en jeu – masses ou volumes – respectaient des proportions bien définies dans un corps décomposable. Un peu plus tard, Marcellin Berthelot (1827-1907) allait développer la thermochimie. Un autre champ de recherche s'ouvrit avec les rapports de la chimie et de l'électricité : l'électrolyse invitait à penser que certaines particules constituant les métaux sont porteuses de charges électriques.
Simultanément se développèrent les deux grandes branches de la chimie que sont la chimie minérale et la chimie organique. La seconde étudie les différents corps qui se rencontrent dans les organismes vivants et la première étudie tous les autres. La distinction a d'abord eu une valeur théorique, parce qu'il n'allait pas de soi pour tous les hommes de sciences que le phénomène de la vie fût réductible à de simples combinaisons d'éléments matériels. Le courant vitaliste soutenait qu'un principe propre aux corps vivants leur assurait leur spécificité. Cette position perdit ses défenseurs lorsque l'on commença à réaliser les synthèses des corps organiques, le premier étant l'urée (par l'Allemand F. Wöhler, en 1828). La différence entre chimie générale et chimie minérale a néanmoins conservé une valeur pratique, tant les constituants des organismes vivants sont complexes.
L'élaboration de la théorie atomique

La chimie du xixe s. ne pouvait pas bénéficier pleinement de l'appui de la physique atomique puisque ce n'est que tout à la fin que les physiciens établirent définitivement l'existence de l'atome et commencèrent à en analyser la structure. Il n'en reste pas moins que la chimie, tout en se développant de manière empirique, commença tôt d'élaborer une véritable théorie atomique. L'idée d'atome n'était pas nouvelle, mais on n'en avait encore rien tiré d'utile. John Dalton fut le premier à soutenir que chaque corps simple devait être constitué de particules toutes identiques entre elles qui, en s'associant à celles d'un autre corps simple d'une façon bien définie, produisait un corps composé, une combinaison. De son côté, l'Italien Amadeo Avogadro (1776-1856) émit l'hypothèse que les gaz sont constitués de particules, qu'il appela « molécules », constituées d'atomes. L'idée fit son chemin lentement, d'abord de façon assez chaotique. La chimie organique, trouvant dans les arrangements d'atomes un bon répondant aux diverse fonctions qu'elle étudiait (acide, alcool…), donna l'impulsion décisive en sa faveur vers le milieu du siècle. La théorie atomique était une hypothèse qui allait prendre de plus en plus l'allure d'une vérité.

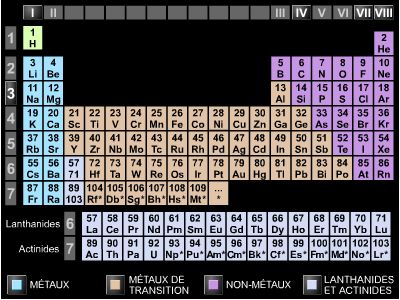
La théorie des éléments, du moins, s'affermissait. Le Russe Dimitri Mendeleïev (1834-1907) en présenta un classement sous la forme d'un tableau. Il traduisait ainsi le fait que, lorsqu'on rangeait les éléments connus par poids atomique croissant, on en retrouvait de manière périodique qui présentent les mêmes propriétés. Les cases qu'il dut laisser vides amenèrent à chercher, et à trouver, des éléments inconnus.
Les apports de la physique atomique
Au tournant des xixe-xxe s., la découverte de l'électron engagea les physiciens dans une série de découvertes, expérimentales puis théoriques, qui établissaient définitivement l'existence des atomes, mais aussi leur structure interne et certaines lois de son fonctionnement. Une fois l'atome mieux connu, il n'y avait plus qu'à le prendre comme point de départ pour chercher à expliquer le macroscopique à partir du microscopique, le phénoménologique à partir du structurel. La chimie s'est ainsi trouvée réduite à la physique, en principe du moins. Si l'on savait résoudre toutes les équations de la mécanique quantique qui décrivent le fonctionnement de l'atome, on pourrait en déduire celui des molécules et établir ainsi toutes les lois régissant les réactions. Cependant, ce programme ne semble pas réalisable en pratique, pour des raisons d'ordre mathématique.
Il n'en reste pas moins que si, du seul point de vue macroscopique, la chimie semble jouir d'une bonne part d'indépendance vis-à-vis de la physique, le point de vue microscopique gomme entièrement la frontière théorique entre ces deux sciences. En outre, c'est la physique qui étudie les transformations des noyaux d'atomes qui se produisent dans le phénomène de la radioactivité. C'est elle aussi qui étudie les diverses transformations de ces particules, protons et neutrons, dont les noyaux sont constitués. Dans ce grand jeu de construction que semble être la nature, la chimie peut être définie comme la partie de la physique qui a en charge les modifications des molécules et autres groupements d'atomes.
Les notions de base
Atomes et éléments
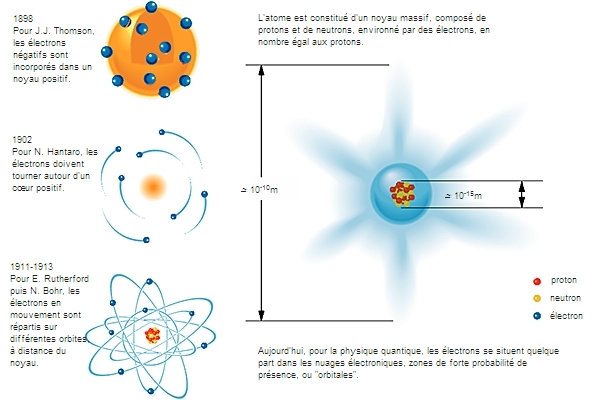

La chimie considère les atomes comme ses constituants de base. Elle doit tenir compte partiellement de leur structure, à cause de légères modifications que celle-ci peut subir et qui jouent un rôle dans les réactions, à commencer par l'ionisation.
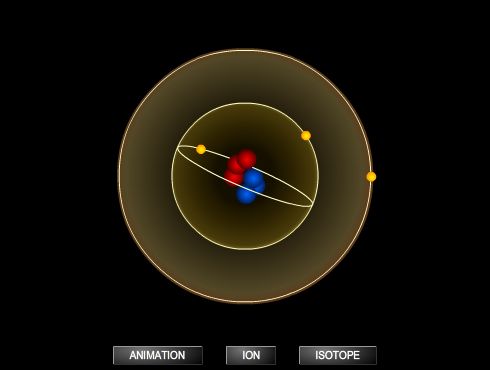
L'atome est constitué d'un noyau autour duquel gravitent des électrons, un peu à la manière des planètes autour du Soleil. Il a été établi qu'il existe un certain nombre de types d'atomes, un peu plus d'une centaine. Chacun de ces types est appelé élément chimique et désigné par un symbole (exemple : Cl pour le chlore). Un élément est défini par le nombre de protons présents dans le noyau de ses atomes. Chaque proton porte une charge électrique, dite « élémentaire », qui est positive. Chaque électron porte une charge de même valeur mais négative. Un atome, au sens strict du mot, comporte autant d'électrons que de protons ; il est donc électriquement neutre. Le nombre des protons, ou des électrons, s'appelle aussi le numéro atomique de l'élément : on le désigne par Z.
Un ion est un atome, ou une molécule, qui a perdu ou gagné des électrons. Si l'atome de fer perd deux électrons, donc deux charge négatives, deux des charges positives, portées par des protons, n'ont plus leur répondant. Aussi symbolise-t-on l'ion obtenu par Fe2+.
Dans le noyau se trouvent également des neutrons, électriquement neutres, dont la masse est voisine de celle du proton. Le nombre des neutrons, pour un élément donné, est du même ordre de grandeur que celui des protons, mais il n'est pas entièrement déterminé. Pour le chlore, par exemple, Z = 17. Si les atomes le chlore comptent en général 18 protons, une certaine proportion d'entre eux (un quart environ) en comportent 20. On dit que les deux variétés sont deux isotopes du chlore.
Corps simples et corps composés
Dans la nature, les atomes d'un élément n'évoluent pas toujours en toute indépendance. Le chlore est un gaz constitué de molécules : chacune d'entre elles est constituée de deux atomes – on préfère dire d'ailleurs le dichlore (ou chlore diatomique), afin de mieux distinguer ce corps simple de l'élément chlore. Le néon (Ne), lui, est un gaz constitué de simples atomes – on parle alors de molécules monoatomiques. Un même élément, comme l'oxygène (O), peut être à la base de différents corps simples, tels le dioxygène (O2) et l'ozone (O3), qui ont des propriétés physiques et chimiques différentes.
Lorsque les molécules d'un corps sont constituées d'éléments différents, on a affaire à un corps composé (ou combinaison chimique) : tel est le cas de l'eau, dont la molécule comporte un atome d'oxygène et deux atomes d'hydrogène (H2O).
La molécule n'est pas le seul mode de groupement des atomes. Ceux-ci peuvent adopter, en grand nombre, une disposition très régulière. On a alors un cristal. C'est ainsi que se présente le diamant, qui n'est composé que d'atomes de carbone. C'est le cas également du chlorure de sodium, constitutif du sel de table. Les atomes de sodium (Na) et de chlore (Cl) s'y rencontrent en quantités égales et très régulièrement disposés. La notation NaCl, qui s'emploie dans ce cas, ne désigne donc pas une molécule : elle signifie que les deux éléments sont présents en quantités égales.
Mélanges et solutions
L'air n'est pas considéré comme un corps : c'est un mélange, parce que l'on y rencontre des molécules de dioxygène ainsi que des molécules de diazote (N2). La proportion de ces dernières reste proche des quatre cinquièmes. Le mélange reste néanmoins de l'air si l'on fait croître tant soit peu cette proportion. Dans un corps composé, au contraire, les proportions des éléments présents suivent des rapports bien définis : un C pour un O (monoxyde de carbone), ou alors un C pour deux O (dioxyde de carbone).
Dans un cristal tel que NaCl, on a plutôt affaire à des ions Na+ et Cl− qu'à des atomes Na et Cl. En dissolvant du chlorure de sodium dans l'eau, on en forme une solution, dont l'eau est le solvant et le chlorure de sodium le soluté. Dans ce cas, la dissociation du cristal s'effectue complètement en ions Na+ et Cl−, indépendants les uns des autres.
Les réactions chimiques
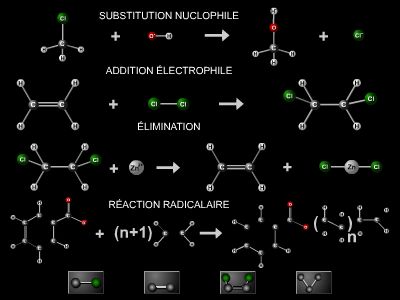
Une réaction chimique détruit les réactifs et donne des produits. Les uns et les autres sont des corps, purs ou composés. Un mélange ne réagit pas en tant que tel : ce sont les corps qui le composent qui réagissent. La combustion de l'hydrogène dans l'air, par exemple, consiste en une combinaison avec le seul oxygène présent dans ce dernier.
L'équation de la réaction indique les réactifs et les produits ainsi que les proportions entre les nombres de molécules qui entrent en jeu. L'équation 2 H2 + O2 → 2 H2O indique que deux molécules de dihydrogène se combinent avec une molécule de dioxygène pour donner deux molécules d'eau. Ces proportions, dites « stœchiométriques », sont imposées par le principe de conservation des atomes : elles constituent la seule manière d'avoir autant d'atomes d'hydrogène avant et après la réaction (à savoir quatre) et de même pour l'oxygène (à savoir deux). Si les molécules des réactifs ne respectent pas la proportion de 2 à 1, celles qui seront en excès ne participeront pas à la réaction. Les coefficients 2, 1 et 2 qui affectent respectivement les trois symboles de molécules sont les coefficients stœchiométriques.
La cinétique chimique étudie les vitesses auxquelles les réactions se déroulent. Certaines peuvent être si lentes que l'on considère qu'elles ne démarrent pas. Afin d'augmenter leur vitesse, ce qui est donc parfois nécessaire pour que, pratiquement, elles aient lieu, on leur adjoint un catalyseur. Celui-ci ne réagit pas avec les autres corps, du moins si l'on ne regarde que le bilan final de la réaction.
La mole
Pour les réactifs solides et les liquides, les chimistes s'intéressent plutôt aux masses. Pour les gaz, les volumes sont plus aisés à mesurer.
Dans l'usage courant, il n'est pas envisageable de faire appel aux masses des différents atomes pour tirer des masses des réactifs ou des produits les nombres d'atomes en jeu. C'est pourtant nécessaire, pour savoir si les proportions stœchiométriques sont respectées, mais les calculs seraient fastidieux. On remédie à cette complication en ne considérant plus les molécules que par grandes quantités.
La mole (abréviation mol) est l'unité de quantité de matière. Une mole d'atomes H est un ensemble de Na atomes H, Na désignant le nombre d'Avogadro (de l'ordre de 6 × 1023). De même, une mole de molécules de dioxygène est un ensemble de Na molécules O2 ; il s'y trouve donc deux moles d'atomes O. L'intérêt de prendre un très grand nombre de corpuscules est d'avoir affaire à un ordre de grandeur accessible à l'expérience. L'intérêt tout particulier de la constante d'Avogadro est que la masse molaire ainsi formée est un nombre simple pour la plupart des éléments : par exemple, 1 gramme pour l'hydrogène, 8 pour l'oxygène, 12 pour le carbone.
L'équation 2 H2 + O2 → 2 H2O, qui parle fondamentalement des atomes et des molécules, peut alors être réinterprétée : elle dit aussi que deux moles de molécules de dihydrogène réagissent avec une mole de [molécules de] dioxygène pour donner deux moles d'eau. En lisant dans une table que les masses molaires de H et de O valent respectivement 1 et 8, on obtient 2 pour celle de H2 et 16 pour celle de O2. La masse des deux moles de H2 est donc 4 g. On voit ainsi aisément que, si l'on met en présence 4 g de dihydrogène avec 16 g de dioxygène, la composition est stœchiométrique. Il n'en est pas de même si l'on combine 40 g de dihydrogène et 170 g de dioxygène, auquel cas 10 g de ce dernier sont en excès.
Masse molaire, volume molaire, concentration
L'usage systématique de la notion de mole amène à employer quelques notions associées et des formules appropriées. Le nombre n de moles présentes pour une espèce, la masse m et la masse molaire M de ce corps sont liées par la formule : m = n.M. Pour les gaz, le volume V et le volume molaire Vm sont reliés semblablement par V = n.Vm. Le volume molaire – volume occupé par Na molécules – a la particularité d'être pratiquement le même pour tous les gaz (22,4 l.mol−1 à 0 °C et à la pression atmosphérique normale).
Dans le cas d'une solution, le solvant n'a d'importance que par son volume. C'est le soluté qui réagit avec un corps que l'on place dans la solution, ou bien avec le soluté d'une autre solution que l'on mélange à la première. Dans une telle situation, le lien entre le volume de la solution et la quantité de soluté qui s'y trouve se fait par l'intermédiaire de la concentration [molaire]. Celle-ci est le quotient de la quantité de soluté présente par le volume total (celui du solvant, pratiquement). Elle s'exprime donc en moles par litres (mol/l, ou mol.l−1). Son intérêt réside dans le fait que la solution peut en principe être considérée comme homogène : la concentration est la même quelle que soit la portion de la solution considérée. Sa connaissance permet donc de convertir le volume de toute fraction de la solution en une quantité de soluté présente dans cette fraction. Le calcul se fait par la formule c = n / V, où n est le nombre de moles. On peut aussi faire appel à la concentration massique, quotient de la masse du soluté par le volume.
La chimie aujourd'hui
La chimie revêt aujourd'hui une très grande importance sur le plan de la recherche et sur le plan économique.
D'une part, elle est à l'interface de nombreuses autres disciplines scientifiques, principalement la physique et la science des matériaux, la biologie et les sciences du vivant, le génie des procédés et les sciences de l'ingénieur.
D'autre part, elle intervient dans de très nombreux processus industriels. L'industrie chimique proprement dite, en particulier la pétrochimie, constitue un secteur de poids dans les économies industrialisées. La chimie joue un rôle décisif dans la production des matériaux (matières plastiques, composites, fibres synthétiques), des médicaments, des produits cosmétiques, des colorants, des explosifs, des carburants, des engrais, etc. La chimie fait désormais partie intégrante de notre vie quotidienne puisqu'elle intervient dans notre alimentation, notre habillement, notre santé, nos loisirs, etc.