métal
(latin metallum, du grec metallon)

Élément chimique caractérisé par une forte conductivité thermique et électrique, un éclat particulier dit « éclat métallique », une aptitude à la déformation et une tendance marquée à former des cations.
CHIMIE
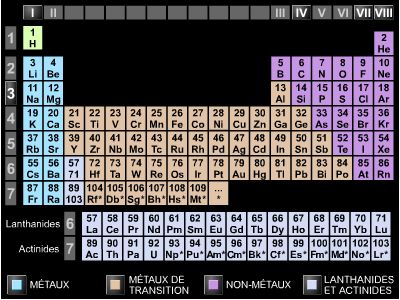
Les métaux constituent plus des deux tiers des éléments de la classification périodique. Ils se présentent sous forme de solides cristallins ayant en commun des propriétés physiques et chimiques intéressantes liées à leur structure cristalline et électronique.
On peut les classer en plusieurs familles.
Les métaux alcalins (colonne I A de la classification) sont d'excellents réducteurs, de couleur blanc argent, présentant l'éclat métallique et des propriétés thermiques et électriques intéressantes. Ils n'ont cependant pas de propriétés mécaniques remarquables : ils sont mous, peu denses, malléables et ductiles. Ils ont un point de fusion relativement bas. Ce sont les métaux les plus électropositifs et donc chimiquement les plus réactifs en raison de leur facilité à fournir des électrons par ionisation.
Les métaux alcalinoterreux (colonne II A) sont des éléments très réactifs présentant l'éclat métallique et de bonnes propriétés électriques et thermiques. Leurs propriétés sont moins marquées que celles des métaux alcalins et ils sont moins réducteurs. Toutefois, ils sont plus durs.
Les métaux de transition (colonnes III B à II B) sont caractérisés par un remplissage des couches électroniques qui s'effectue préférentiellement dans des couches autres que les couches externes. Ils présentent un caractère métallique marqué (malléabilité, ductilité, conductibilité électrique et thermique, éclat métallique).
État naturel et élaboration des métaux
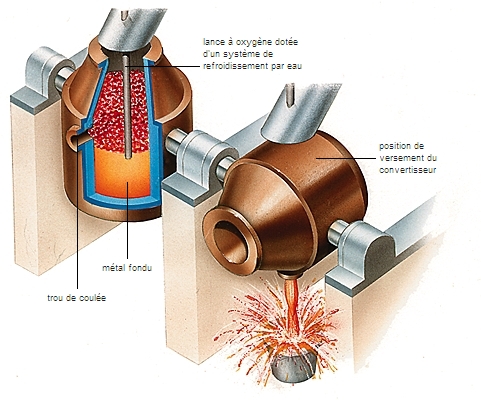
Les métaux sont principalement extraits des mines, sous la forme de minerais impurs. Ils sont ensuite purifiés puis préparés par des procédés physiques (concassage, criblage, etc.) et chimiques (distillations, électrolyse, etc.).
Associé à d’autres constituants, un métal forme un alliage. Les alliages possèdent d’autres propriétés (propriétés mécaniques, résistance thermique, conduction électrique, etc.) que chacun de ses composants.
Protection
La protection d'une pièce métallique peut s'effectuer par revêtement d'une couche de métal (métallisation), de peinture, de phosphates (phosphatation), de chromates (chromatation), d'oxydes, etc. Les procédés peuvent être utilisés conjointement, par exemple phosphatation ou chromatation suivie de l'application d'un vernis ou d'une peinture, dont l'accrochage est facilité par la couche sous-jacente formée.
Propriétés des métaux
Les éléments métalliques présentent une structure électronique particulière : les électrons les plus éloignés du noyau peuvent s’échapper lorsqu’ils acquièrent de l’énergie (par exemple, sous forme électrique ou thermique).
Lorsqu’un potentiel électrique est appliqué à un métal, une partie de ses électrons se met en mouvement et forme un courant électrique : les métaux sont conducteurs d’électricité (le plus conducteur de tous étant l’argent).
De même, lorsque l’on chauffe un métal, ses électrons participent à leur tour à l’agitation thermique du métal : les métaux sont conducteurs de chaleur.
Du fait de leurs conductivités électrique et thermique, les métaux sont utilisés pour le transport de l’électricité (principalement le cuivre) et dans les appareils de chauffage.
La température de fusion d’un métal est très variable : de – 39 °C pour le mercure à 3 422 °C pour le tungstène. C’est pourquoi ce dernier est utilisé dans la fabrication des ampoules électriques : au passage du courant, le filament de tungstène émet de la lumière tout en résistant à la chaleur qu’induit ce même courant.
Les métaux sont généralement mous, peu résistants et plutôt élastiques : ils peuvent reprendre leur forme initiale sans se casser, lorsqu’ils sont soumis à une dilatation.
Certains métaux réagissent avec l’oxygène présent dans l’air ou dans l’eau et « rouillent » (plus précisément, ils s’oxydent) : c’est la corrosion. Le cuivre s’oxyde en présentant un dépôt vert, qui donne par exemple sa couleur à la statue de la Liberté. Dans certains cas, pour le fer par exemple, l’oxydation peut détruire entièrement le métal. Il est possible d’éviter à un objet métallique de s’oxyder en le recouvrant de peinture ou de vernis, ou bien encore d’un type de métal qui ne s’oxyde pas (on parle généralement de traitements de surface). C’est le cas par exemple du fer-blanc des boîtes de conserve, constitué de fer recouvert d’étain (l’étain est un métal qui ne s’oxyde pas). L’acier inoxydable est un alliage de fer, de carbone, de nickel et de chrome qui présente également la particularité de ne jamais s’oxyder.
Par ailleurs, il est important de noter que certains métaux (les métaux lourds) sont toxiques pour l’organisme, en particulier le plomb qui est responsable du saturnisme.
Utilisation des métaux

Les premières traces d’exploitation des métaux sont découvertes au Proche-Orient et dans le sud-est de l’Europe ; elles remontent à environ 5000 ans avant J.-C. Les hommes apprennent tout d’abord à extraire puis à travailler le cuivre, qui sert notamment à la fabrication d’objets décoratifs (bijoux, statuettes, etc.). Employé un temps dans la fabrication d’armes, le cuivre est progressivement supplanté par le bronze, plus résistant, à l’âge du bronze (vers 2000 avant J.-C.). Le bronze est un alliage, obtenu par mélange de cuivre et d’étain. Sa découverte marque une étape dans l’histoire de la métallurgie : en inventant les alliages, les hommes créent les matériaux dont ils ont besoin (des matériaux aux propriétés spécifiques).
À l’âge du fer (vers 1000 avant J.-C.), les hommes apprennent à travailler le fer, qui sert aussi bien à la réalisation d’objets du quotidien que d’outils ou encore d’armes. Les métaux précieux, comme l’or et l’argent, sont réservés aux bijoux et aux parures. Bien que moins résistants, ils sont bien plus maléables, et donc plus faciles à travailler que les autres métaux. La métallurgie du fer et de l’acier (alliage très résistant de fer et de carbone) naît au xviie siècle, puis vient le temps de l’aluminium, métal très léger, au xixe siècle.
À partir du xxe siècle, les métaux vont se retrouver dans tous les domaines d’activités : électricité, électronique, transports, bâtiment, mobilier, etc.
Les métaux rares
La notion de rareté des métaux a beaucoup évolué au cours des temps. L'aluminium, tenu pour rare avant 1900, car difficile à préparer, représente pourtant 8 % de la croûte terrestre. C'est aujourd'hui le métal le plus utilisé après le fer et l'acier. Aussi ne faut-il considérer comme rares que les métaux qui sont en très faible pourcentage dans la nature.
Les éléments radioactifs artificiels posent problème par rapport à cette définition. En effet, ils peuvent être extrêmement rares dans la nature sous forme d'un isotope, mais relativement abondants sous forme d'un autre isotope produit artificiellement.
Pour plus d'informations, voir l'article métal rare.
Les métaux lourds
Regroupant une large gamme d'éléments, tels que le cuivre, le plomb, le mercure, le cadmium, le manganèse, le zinc, etc., les métaux lourds, métaux de masse atomique élevée, sont tous présents dans l'environnement naturel, à de faibles concentrations. Certains sont indispensables aux plantes comme aux animaux, à de très petites quantités (oligoéléments), mais ils deviennent toxiques à des doses plus élevées. Ils présentent des phénomènes d'accumulation le long des chaînes alimentaires.







