cristal
(latin crystallus, du grec krustallos, glace)

Solide de matière homogène présentant une structure atomique ordonnée et une forme extérieure limitée par des surfaces lisses, planes, disposées symétriquement (faces).
PHYSIQUE

La plupart des matériaux solides possèdent une disposition atomique ordonnée et sont de structure cristalline. Les solides n’ayant pas de structure cristalline, comme le verre, sont dits amorphes. Ainsi les objets de verrerie en cristal sont composés de matière amorphe et par conséquent ne sont pas des cristaux au sens physique du terme.
Pour en savoir plus, voir l'article cristal [VERRE].



Les cristaux les plus communs sont la neige, le sucre, les sels, les silicates, les oxydes, les sulfures, les métaux et les gemmes (diamant, rubis, etc.).
1. Formation et croissance des cristaux
1.1. Principes généraux


La matière cristallisée est très fréquente dans la nature. Toutefois, en dehors de certains cristaux d'origine géologique dont la taille peut atteindre plusieurs mètres (comme les cristaux géants de gypse de la célèbre grotte de Naica au Mexique), la matière cristalline se présente plus fréquemment sous une forme dite polycristalline correspondant à un ensemble compact et désordonné de petits cristaux de taille souvent très inférieure au millimètre. En effet, la croissance d’un cristal obéit à des lois précises et sa formation dépend de différents facteurs, en particulier de la pression et de la température de son environnement de formation.


Un cristal se forme lorsqu’un solide se constitue progressivement à partir d'un fluide, que ce soit par congélation d'un liquide, par dépôt (ou précipitation) d'une substance dissoute ou par condensation directe d'un gaz.
1.2. Les sites de nucléation des polycristaux

Si on laisse refroidir un matériau cristallin fondu, il se solidifie en recristallisant. Cette recristallisation ne se fait pas d’un bloc : elle s’initie en divers endroits du cristal, puis se propage progressivement à tout le volume. De manière plus précise, la cristallisation débute en surface, où la température est plus faible qu’au cœur du matériau. Dans ce dernier, la cristallisation s’initie préférentiellement en certains endroits appelés sites de nucléation.
Les impuretés et autres défauts constituent d’excellents sites de nucléation. Ce mode de croissance explique l’existence des polycristaux : à partir de chaque site, la cristallisation ne se fait pas forcément avec la même orientation ; ainsi, au centre de chaque grain d’un polycristal se trouve un site de nucléation.
1. 3. Obtention de monocristaux
Pour obtenir un monocristal, il faut donc partir d’un produit extrêmement pur. Toutefois, cela ne suffit pas : il faut également procéder à un refroidissement lent et contrôlé. En effet, si le refroidissement est trop brutal, les atomes n’ont pas le temps de s’arranger de manière parfaite, ce qui favorise l’apparition de défauts. C’est ce qui se passe lorsque l’on procède à la trempe des aciers : on contrôle le nombre de défauts nécessaires pour obtenir la dureté voulue.

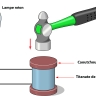
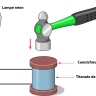
Les méthodes modernes d’obtention des monocristaux (procédé Verneuil, procédé de Czochralski), procédé par dissolution anhydre…) sont fondées sur la technique épitaxique : il s’agit de faire croître le cristal en couches, en faisant des dépôts successifs. Ces méthodes sont largement utilisées dans l’industrie des semi-conducteurs pour réaliser les composants électroniques, dont les puces des ordinateurs. En effet, dans ces dispositifs, le moindre défaut constitue un véritable poison pour les propriétés électroniques ; c’est pourquoi on utilise des matériaux dont la pureté atteint 99,999 999 99 %.
Maîtriser les conditions de croissance est donc primordial pour l’obtention de cristaux de grande pureté, qui seront utilisés aussi bien dans la recherche fondamentale que dans l’industrie (lasers, semi-conducteurs, scintillateurs, etc.).
2. Les systèmes cristallins
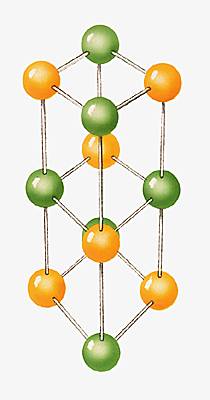
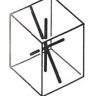
On distingue, en théorie, 32 classes de cristaux qui sont regroupées en sept systèmes cristallins, fondés sur la longueur et la disposition des axes des cristaux − lignes imaginaires passant par le centre du cristal, coupant les faces et définissant les relations de symétrie du cristal. Les cristaux de chaque système partagent certains détails de symétrie et de forme cristalline, ainsi que de nombreuses propriétés optiques.
Ces sept systèmes de cristallisation, décrits ci-dessous, sont très importants pour les minéralogistes et les gemmologues (spécialistes des pierres précieuses) qui y recourent pour la description de chaque minéral.
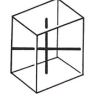
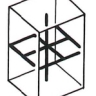
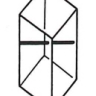
2.1. Cubique
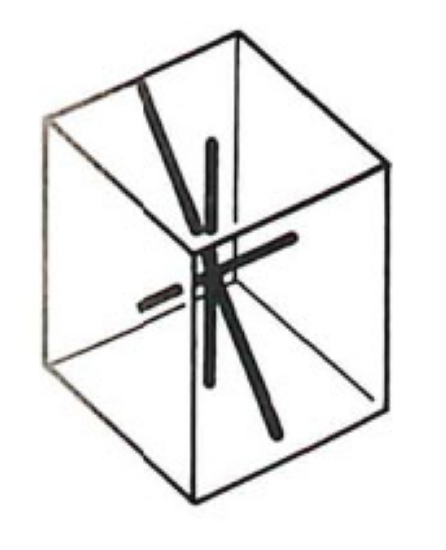
Ce système comprend des cristaux présentant trois axes, tous perpendiculaires entre eux et tous de même longueur. L'élément de base est un cube.
2.2. Quadratique ou tétragonal
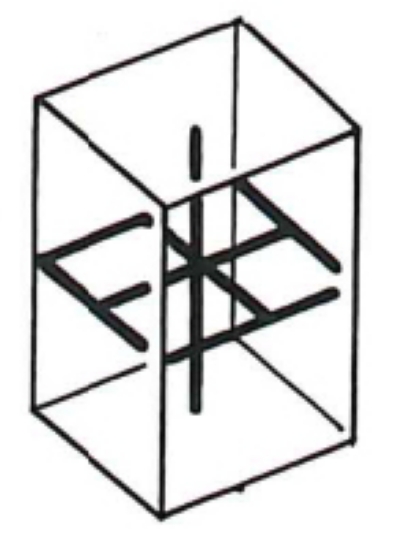
Ce système comprend des cristaux présentant trois axes, tous perpendiculaires entre eux et dont deux sont de même longueur. L'élément de base est un prisme droit à base carrée.
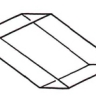
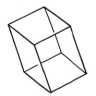
2.3. Orthorhombique
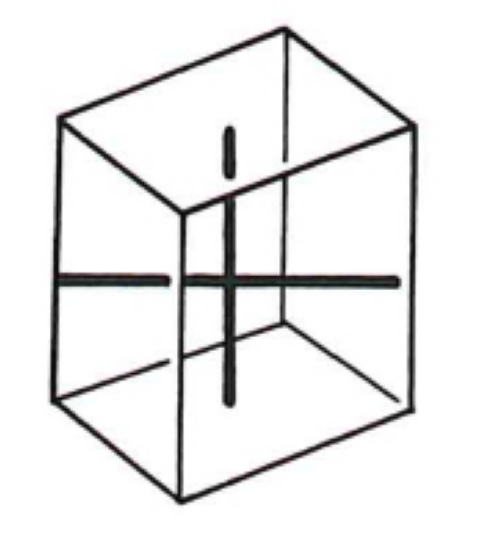
Ce système comprend des cristaux présentant trois axes, tous perpendiculaires entre eux et tous de longueur différente. L'élément de base est un parallélépipède rectangle.
2.4. Monoclinique
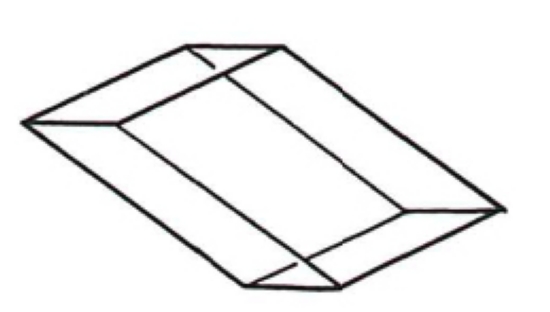
Ce système comprend des cristaux présentant trois axes de longueur inégale, dont deux forment un angle différent de 90°, le troisième leur étant perpendiculaire. L'élément de base est un prisme oblique à base losange.
2.5. Triclinique
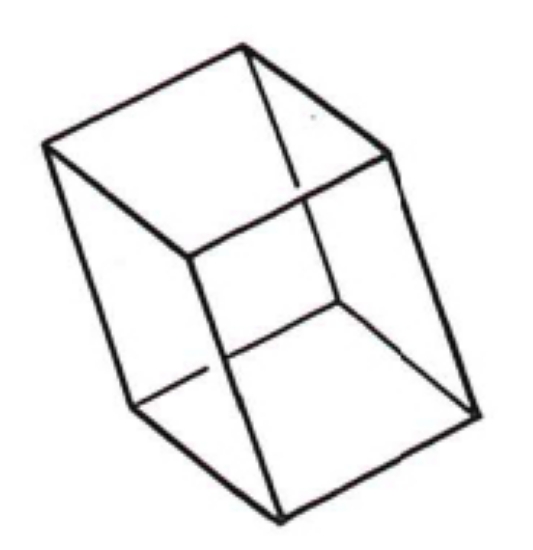
Ce système comprend des cristaux présentant trois axes de longueur inégale et formant entre eux des angles différents de 90°. L'élément de base est un parallélépipède à base losange.
2.6. Hexagonal

Ce système comprend des cristaux présentant quatre axes. Trois de ces axes, de même longueur, sont dans un même plan et font entre eux un angle de 120°. Le quatrième axe, perpendiculaire aux trois autres, est un axe d'ordre 6 (structure symétrique par rotation de 60°). L'élément de base est un prisme droit à base losange.
2.7. Rhomboédrique
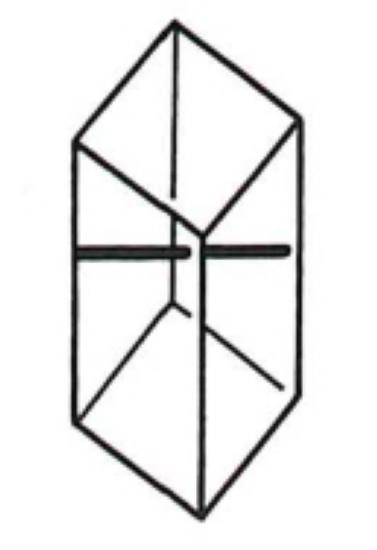
Ce système comprend quatre axes comme le système hexagonal, mais le quatrième axe est d'ordre 3 (structure symétrique par rotation de 120°). L'élément de base est un parallélépipède dont toutes les faces sont des losanges.
2.8. Variantes
Mailles et motifs
Ces systèmes peuvent à leur tour se présenter sous quatre modes différents : simple, centré, à faces centrées, à deux faces centrées. Un cristal « classique » (à l’exception des quasi-cristaux) est donc caractérisé par une figure géométrique (cube, parallélépipède, prisme, etc.), appelée maille du système, qui se répète un grand nombre de fois et qui contient un certain nombre d’atomes ou de molécules (le motif).
Ainsi, un cristal classique est entièrement défini par ses paramètres de maille (longueurs et angles définissant la figure géométrique) et son motif.
Allotropie
Un certain nombre de matériaux peuvent cristalliser dans des systèmes différents créant des substances qui, bien qu'identiques dans leur composition chimique, sont différentes dans pratiquement toutes leurs propriétés physiques : on parle alors de formes allotropiques.

Par exemple, les trois variétés allotropiques les plus connues du carbone sont : le diamant, le graphite et le fullerène − la quatrième forme étant le carbone amorphe. Le diamant, matériau naturel le plus dur, présente une structure cubique à faces centrées ; le graphite cristallise dans le système hexagonal, généralement sous la forme de prismes aplatis friables ; et la célèbre structure du fullerène C60 − qui ressemble à un ballon de football − correspond à un icosaèdre tronqué (constitué de 20 hexagones et 12 pentagones), où chaque atome de carbone est situé à l'un des 60 sommets du polyèdre inscrit dans une sphère.
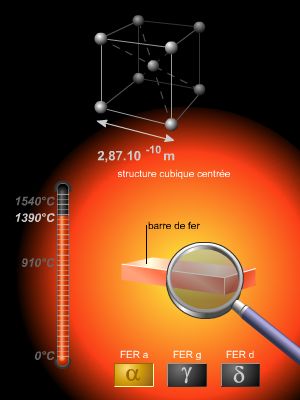
De même, le fer se présente sous un mode cubique centré à température ambiante (fer alpha), mais passe à une structure cubique à faces centrées au-dessus de 906 °C (fer gamma).
3. Propriétés et applications des cristaux
Les nombreuses propriétés physico-chimiques des cristaux dérivent directement de leur structure cristalline et notamment de leurs défauts structuraux. Par exemple, les propriétés exceptionnelles du diamant (l’une des formes allotropiques du carbone) − sa dureté, sa conductibilité thermique (→ conduction) et sa transparence à la lumière − sont parfaitement révélées par la connaissance de l’arrangement géométrique de ses atomes (système cubique à faces centrées).
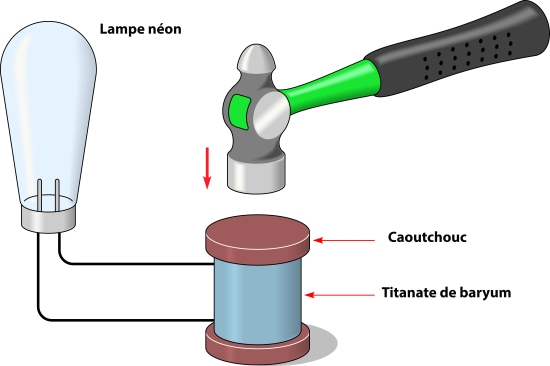
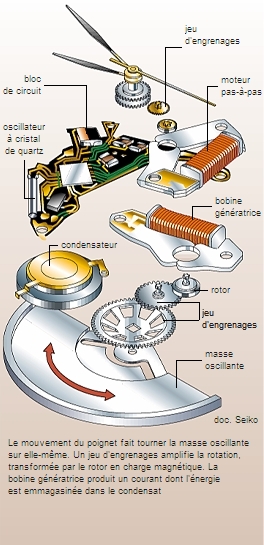
Par ailleurs, certains cristaux acquièrent des charges électriques lorsqu’ils sont soumis à une pression (phénomène de piézoélectricité) ou sous l’effet de chaleur (phénomène de pyroélectricité). C’est notamment le cas des cristaux piézo-électriques de quartz, capables de transformer de façon réversible une énergie électrique en énergie mécanique, et qui sont utilisés pour ces raisons dans les montres à quartz, des briquets...

D’autres cristaux, comme ceux de germanium et de silicium, présentent des propriétés semi-conductrices, qui sont mises à profit notamment dans les transistors pour amplifier le courant électrique. On retrouve ces cristaux semi-conducteurs dans bon nombre d’appareils du quotidien puisqu’ils sont largement utilisés dans la fabrication des composants de la microélectronique (matériel informatique, électroménager, audiovisuel…).

Certains cristaux semi-conducteurs présentent en plus la propriété très intéressante d'émettre de la lumière cohérente et entrent donc dans la fabrication de lasers dits solides (laser à rubis, laser YAG − grenat d’yttrium et d’aluminium, etc.) utilisés en recherche fondamentale, en médecine et dans l’industrie (principalement pour l’usinage de matériaux et en télémétrie laser).
Les cristaux présentant des propriétés magnétiques sont utilisés dans la fabrication de différents supports d'enregistrement (principalement les cartes à puces).
Des cristaux de sulfure de silicium ou de cadmium sont utilisés dans les cellules photoélectriques pour convertir l’énergie solaire en énergie électrique.

Il existe également des cristaux qui ont la propriété de changer de couleur sous l'effet d'une variation de température ou de champ électrique : ce sont les cristaux liquides. Ils sont utilisés pour l'affichage d'informations sur divers appareils : montres, thermomètres, calculatrices, écrans d’ordinateur, etc.
Enfin, un dernier type de cristaux, les quasi-cristaux, présentent une structure non périodique induisant des propriétés physico-chimiques très atypiques qui font l’objet d’intenses recherches en physique du solide et en métallurgie.
Pour en savoir plus, voir l'article cristallographie.