soufre
(latin sulfur)

Corps simple solide, non métallique, d'une couleur jaune citron. (Élément chimique de symbole S.)
- Numéro atomique : 16
- Masse atomique : 32,06
- Masse volumique : 1,56 g/cm3
- Température de fusion : 112,8 °C
CHIMIE

Connu depuis l'Antiquité, et identifié comme élément chimique par Lavoisier, le soufre est un solide sans odeur ni saveur, mauvais conducteur de la chaleur et de l'électricité. Chauffé, il fond vers 113 °C en donnant un liquide jaune clair, puis devient visqueux et brunit ; vers 220 °C, il est noir et ne coule plus ; puis il redevient fluide, en restant noir ; il bout enfin à 444,6 °C. Le soufre existe sous deux formes cristallines. Préparé à froid par évaporation de ses solutions, il se présente en octaèdres du système orthorhombique (soufre octaédrique ou α), de densité 2,06 ; à chaud, par refroidissement du soufre fondu, il cristallise en aiguilles du système monoclinique (soufre prismatique ou β), de densité 1,96. Le soufre mou est un solide brun, pâteux et élastique, obtenu en versant dans l'eau froide le soufre fondu à sa température d'ébullition.
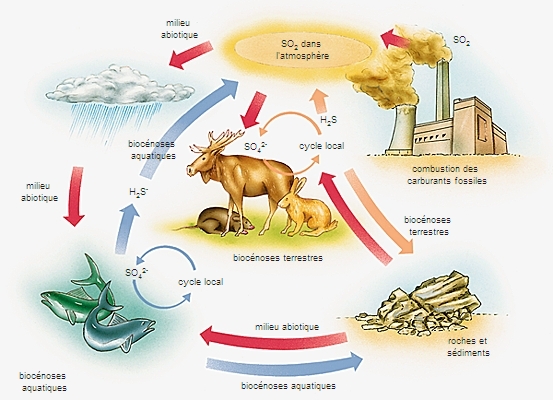
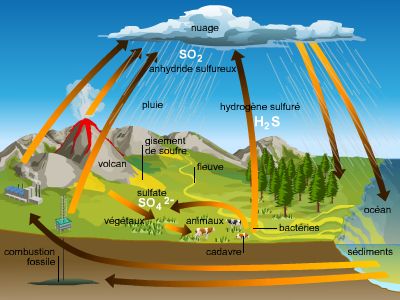
Chimiquement voisin de l'oxygène, le soufre s'unit à chaud à l'hydrogène et au carbone pour donner l'acide sulfhydrique H2S et le sulfure de carbone CS2. Il se combine directement au fluor, au chlore et au brome, et brûle dans l'air avec une flamme bleue en donnant du gaz sulfureux SO2. Constituant 0,06 % de la lithosphère, le soufre se trouve à l'état natif dans le voisinage des anciens volcans (Sicile, Louisiane, Japon). Plus fréquemment, il est combiné aux métaux, et les sulfures de fer, de cuivre, de plomb, de zinc constituent d'importants minerais de ces métaux. Enfin, il se trouve sous forme d'hydrogène sulfuré dans certains gaz naturels, comme celui de Lacq, qui en contient 15 % en volume. Il figure aussi dans la houille et les pétroles (de 1 à 2 %). Brut, il sert à la fabrication du gaz sulfureux, de l'acide sulfurique, du sulfure de carbone, des thiosulfates, etc. Purifié, il entre dans la composition de la poudre noire et de feux d'artifice. On l'emploie aussi pour la fabrication des allumettes, la vulcanisation du caoutchouc et la préparation de l'ébonite.
PHARMACIE
Le soufre est utilisé par voie interne comme laxatif doux et en applications externes (lotions, pommades), pour ses propriétés antiparasitaires, kératolytiques et antiséborrhéiques.










