combustion
(bas latin combustio, -onis, de comburere, brûler)

Ensemble des phénomènes qui se produisent lors d'une oxydation exothermique.
CHIMIE ET THERMIQUE

La combustion est une réaction chimique (oxydoréduction) qui met en œuvre un combustible et un comburant (le premier est un corps réducteur, le second un oxydant) : elle fournit de l'énergie calorifique et émet généralement de la lumière. Sur la maîtrise de cette réaction se fondent le développement de la société industrielle et la sauvegarde de l'environnement.
1. Naissance de la théorie moderne sur la combustion

Les premiers « combustionnistes » sont les hommes de la préhistoire ; le feu conférait à celui qui savait le maîtriser un statut de sorcier. L'importance du culte du feu dans certaines civilisations ou l'existence de mythes comme celui de Prométhée indiquent une fascination que les flammes ont toujours exercée sur les hommes. Il faut cependant attendre la fin du xviiie s. pour que se développe une étude sérieuse des phénomènes mis en œuvre dans la combustion.

C'est en s'intéressant à ce sujet, et grâce à la découverte quasi simultanée entre 1773 et 1774 de l'oxygène par le Suédois Carl Wilhelm Scheele et le Britannique Joseph Priestley, que le Français Antoine Laurent de Lavoisier va écrire les véritables premiers bilans réactionnels et fonder la chimie moderne.
1.1. Le phlogistique

Jusqu'au xviiie s., les scientifiques admettent les conclusions de l'Allemand Georg Ernst Stahl : le feu, sous la forme du phlogistique, est contenu dans la matière elle-même, et la combustion n'en est que la libération. Cette théorie est d'autant mieux acceptée qu'elle correspond à un retour aux idées des philosophes grecs, notamment à la vision élémentaire d'Aristote sur l'Univers et ses quatre éléments : eau, terre, air et feu.
Mais la faiblesse essentielle de cette théorie était de prédire une diminution du poids de la matière après combustion (à la suite de la perte du phlogistique), alors que les produits de celle-ci sont en réalité plus lourds du poids de l'oxydant utilisé. Le flou entourant les notions de poids et de masse permettait à la théorie de rester toutefois crédible, car il suffisait de se rattacher à la vision aristotélicienne : certains éléments de ce monde vont vers le bas (c'est le principe de ce qui est lourd), d'autres, tel le feu, se dirigent vers le haut. Selon Stahl, le dégagement ou la fixation du phlogistique, agent universel, permettait d'expliquer toute la chimie – la combustion en devenant l'acte fondamental. Cette théorie, bien qu'erronée – elle fut acceptée en partie, grâce à sa simplicité, par toute la communauté scientifique durant un demi-siècle –, contribua à faire de la chimie une véritable discipline scientifique, qui se développa rapidement par la suite.
1.2. La combustion selon Lavoisier
Le phlogistique est, sous certains aspects, le précurseur de l'énergie, concept qui ne sera développé que deux siècles plus tard.

En 1772, Lavoisier dépose sous pli cacheté à l'Académie des sciences ses premiers résultats concernant l'étude de la combustion. Son mémoire présente déjà les faits essentiels suivants : le poids total du vase et de son contenu n'a pas changé après la calcination ; le métal transformé en chaux (de nos jours, on parle d'oxyde) a augmenté de poids ; le poids de l'air contenu dans le vase a diminué de la même quantité. Parmi les scientifiques qui ont, à la suite de Lavoisier, contribué aux progrès de la discipline, il faut citer l'Allemand Robert Wilhelm Bunsen, qui inventa le brûleur connu sous le nom de bec Bunsen, les Français Ernest Mallard et Henry Louis Le Chatelier, qui découvrirent le phénomène de la détonation en 1881 et développèrent une première théorie de la flamme en 1883.
Le terme de combustion avait un sens plus large que celui qui lui est aujourd'hui attribué : il désignait un ensemble de réactions d'oxydoréduction, dont la théorie complète a été élaborée postérieurement. La simple oxydation, que ce soit celle des métaux ou encore celle du glucose (qui se produit lors de la respiration), était dénommée combustion lente. La présence d'une flamme était caractéristique de la combustion vive : c'est à cette dernière que se réfère l'utilisation moderne du mot.
2. Aspects chimiques de la combustion
Si la combustion, dans la vie de tous les jours, nous apparaît comme une réaction très simple, ce processus étudié dans les laboratoires de recherche devient une succession complexe de réactions chimiques.
2.1. Réactions en chaîne
La réaction de combustion la plus simple est assurément celle du dihydrogène par le dioxygène (→ hydrogène, oxygène):
H2 + ½ O2 → H2O + énergie.
La simplicité de cette relation n'est cependant qu'apparente, le mécanisme réactionnel étant en réalité constitué d'une succession de réactions élémentaires.
La première réaction élémentaire est appelée réaction d'initiation. Elle permet de briser la molécule d'oxygène en deux radicaux, et ce grâce à une collision avec un partenaire quelconque, que ce soit une autre molécule ou la paroi du réacteur, afin d'obtenir le second corps de la collision :
(1) O2 + M → 2O* + M.
Le radical obtenu (O*) étant instable, il va réagir facilement, en particulier avec une molécule d'hydrogène :
(2) H2 + O* → *OH + H*,
puis les radicaux nouvellement formés vont à leur tour réagir :
(3) O2 + H* → *OH + O*
et
(4) H2 + *OH → H2O + H*.
Les réactions (2) et (3), qui permettent la diversification et l'augmentation du nombre de radicaux en présence, sont des réactions de ramification, la réaction (4), qui fournit le produit final tout en reformant un radical qui va relancer la réaction (3), est une réaction de propagation. Des réactions défavorables à la combustion sont également possibles :
(5) H* + H + M → H2 + M
(6) *OH + H* + M → H2O + M.
Très exothermiques, elles nécessitent la présence d'un partenaire de choc M quelconque. La réaction (5), qui bloque l'ensemble du mécanisme, est une réaction de rupture, alors que la réaction (6), qui crée le produit final mais ne permet pas la réinitialisation de l'ensemble, est une réaction de terminaison. L'ensemble de ces réactions élémentaires constitue un mécanisme de réactions en chaîne.
2.2. Cinétique chimique
Pour que le produit final soit obtenu, il est absolument nécessaire que la réaction (5) ne soit pas trop rapide, afin d'éviter la formation de molécules d'eau par recombinaison systématique de l'hydrogène (→ cinétique [chimie]). La vitesse d'une réaction élémentaire (la réalité étant plus complexe pour une réaction globale) est proportionnelle à la quantité de chaque réactif nécessaire à cette réaction : plus la concentration d'un corps est importante, plus les collisions entre molécules seront fréquentes. Le coefficient de proportionnalité qui en est déduit dépend également de la température : plus la température est élevée, plus l'énergie cinétique des molécules est forte. Les calculs effectués à partir des données cinétiques élémentaires permettent de juger de la bonne représentation du mécanisme réactionnel complet envisagé.
2.3. Complexité des réactions de combustion
L'étude de la combustion du propane pur (C3H8), corps plus complexe que l'hydrogène, conduit, dans le souci de bien représenter le mécanisme réel de la combustion dans le dioxygène pur, à considérer 126 réactions élémentaires; la réaction globale stœchiométrique s'écrivant :
C3H8 + 5O2 → 3CO2 + 4 H2O + énergie.
Ainsi, lors de l'utilisation du butane, dont les molécules sont plus grandes que celles du propane, on imagine difficilement la complexité du mécanisme réactionnel se produisant dans la flamme du brûleur. Aussi la combustion de produits non purs, tels que les fiouls lourds brûlés dans les centrales thermiques conventionnelles, et qui contiennent plusieurs composés carbonés, soufrés et azotés, est-elle d'une étude particulièrement difficile.
2.4. Combustion complète, combustion incomplète
Les équations globales de combustion écrites précédemment à titre d'exemple pour le dihydrogène et le propane représentent des réactions de combustion complète, car les produits obtenus (CO2, H2O) sont incombustibles : ils ne peuvent à leur tour donner naissance à des réactions de combustion.
En revanche, si la quantité de dioxygène est insuffisante au niveau de la flamme, là où la température est assez élevée pour que les réactions aient lieu, la combustion de la molécule d'oxyde de carbone, composé intermédiaire relativement stable, ne peut être entièrement réalisée. La combustion de cet oxyde est alors incomplète.
La richesse r d'un mélange permet de comparer les proportions d'oxydant et de combustible effectivement en présence dans le milieu réactif :
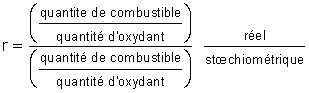

Si ce rapport est supérieur à l'unité, la combustion est nécessairement incomplète. Mais une richesse inférieure à 1 n'est pas une condition suffisante pour qu'une combustion soit complète : celle-ci peut être stoppée pour des raisons cinétiques (vitesse de réaction trop lente) ou mécaniques (combustible et comburant trop éloignés, par suite d'un écoulement défavorable). Les produits obtenus, tel l'oxyde de carbone (CO), étant généralement toxiques, la lutte contre la pollution doit prendre en compte l'élimination des combustions incomplètes.
2.5. Conditions d'inflammation
La présence, en un même endroit, d'un combustible et d'un comburant est requise pour la formation d'une flamme. De plus, cette dernière, qui est caractéristique de la réaction de combustion, nécessite une température – obtenue par une étincelle, par le contact d'un corps chaud ou par chauffage de l'ensemble, en au moins un endroit du mélange – qui doit être supérieure à la température d'inflammation Ti (cette température dépend du mélange considéré et de la pression à laquelle se déroule la réaction).
En outre, la proportion de combustible doit être comprise entre deux valeurs limites Li (limite inférieure au-dessous de laquelle le mélange est trop pauvre pour être inflammable) et Ls (limite supérieure au-dessus de laquelle le mélange est trop riche) ; ces grandeurs dépendent aussi de la nature des réactifs et de la pression (l'influence de la température est alors pratiquement nulle).
Par exemple, la combustion du dihydrogène dans l'air n'est possible que si la proportion en volume du dihydrogène est comprise entre 4 % et 75 % du mélange, et dans les conditions stœchiométriques (30 % environ de dihydrogène en volume) il faut chauffer l'ensemble jusqu'à Ti = 572 °C.
2.6. Combustion dans l'air
La combustion dans l'air diffère de celle qui s'opère dans le dioxygène pur par un effet de dilution thermique.
Ainsi, pour le méthane, la réaction globale de combustion dans l'air s'écrit :
CH4 + 2O2 + 7,52 N2 → CO2 + 2 H2O + 7,52 N2 + énergie.
Dans cette réaction, un terme supplémentaire apparaît : l'azote (3,76 molécules d'azote par molécule d'oxygène) ; les autres composants de l'air (gaz rares) étant négligeables. Rien ne semble changer, pourtant l'énergie obtenue lors de la réaction sert en partie à chauffer une masse plus importante de produits (ici, 258,56 g au lieu de 48 g par molécule de méthane). L'ensemble des produits finals est par conséquent à une température moins élevée, et cette diminution de la température peut être un facteur décisif dans la vitesse de la réaction chimique.
3. Aspects physiques de la combustion
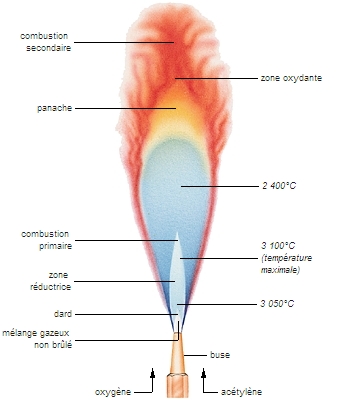
La flamme, en tant que phénomène physique, est la première manifestation de la combustion. On en distingue deux sortes : les flammes de prémélange, ou de mélange préalable, obtenues lorsque le combustible et l'oxydant sont mélangés avant d'être mis en réaction ; et les flammes de diffusion, qui apparaissent à l'interface située entre les deux réactifs principaux non mélangés, ces dernières pouvant se stabiliser grâce aux processus conjugués de diffusion moléculaire et de diffusion thermique.
3.1. Les flammes de prémélange
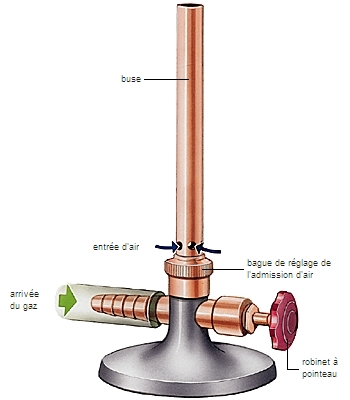
Le bec Bunsen fournit l'exemple de flamme de prémélange, ou de mélange préalable : elle apparaît immobile (en l'absence de turbulences créées par l'air environnant), alors que du mélange combustible est consommé : cela signifie que le front de flamme se déplace à la même vitesse (mais dans le sens contraire) que l'écoulement du prémélange, et qu'elle se trouve ainsi au repos dans le repère du brûleur.
Les trois types de combustion
Ces considérations cinématiques permettent de distinguer trois types de combustion : si la vitesse du front de flamme est lente (inférieure ou égale à environ 1 m/s), c'est une déflagration ; si la vitesse est très supérieure (supersonique et de l'ordre du km/s), il se forme une onde de choc, c'est une détonation (→ son) ; lorsque l'inflammation est si rapide que chaque point du milieu réactif s'enflamme spontanément au même moment, c'est une explosion. Dans ce dernier cas, il n'y a pas de propagation au sens précis du terme, mais un emballement des réactions en chaîne ; ce processus n'est plus gouverné par la mécanique, mais par la chimie.
Il n'existe pas d'intermédiaire stable entre ces trois cas de combustion. Ainsi, le confinement est une condition de la transition entre la déflagration et la détonation, et les domaines d'explosion et de détonation sont des sous-domaines de celui de l'inflammabilité. Il apparaît ainsi que le moteur à explosion, qui équipe en particulier les automobiles, devrait être appelé moteur à déflagration. Mis à part la plupart des moteurs, les flammes de prémélange sont celles des brûleurs de cuisinières à gaz, et les considérations précédentes permettent de comprendre la nécessité de l'adaptation parfaite entre le détendeur, le brûleur et le gaz pour obtenir une flamme stable et non dangereuse.
Dans un autre domaine, des recherches sont actuellement mises en œuvre pour maîtriser la combustion supersonique des superstatoréacteurs devant équiper les avions hypersoniques de demain.
3.2. Les flammes de diffusion
Deux gaz différents se mélangent grâce au mouvement d'agitation thermique qui anime leurs molécules : c'est le phénomène de diffusion. Lorsqu'un combustible et un comburant sont en contact, il va apparaître une zone où seront présentes les conditions de concentration requises pour l'inflammation. Si la température d'inflammation est atteinte dans une partie de cette zone (il suffit que les gaz soient suffisamment chauds ou qu'il y ait un apport énergétique extérieur), une flamme va apparaître.
Cas de l'inflammation spontanée
Dans le cas de l'inflammation spontanée, la flamme prend naissance à l'endroit où les proportions stœchiométriques de la réaction sont observées. Si la combustion est déclenchée par chauffage ponctuel, elle se développe en ce même point, mais la flamme va se déplacer vers sa position d'équilibre (conditions stœchiométriques).
Cas de l'allumage commandé

Dans le cas de l'inflammation commandée, pour que la réaction soit entretenue et que la flamme soit stable, il faut que se réalise un équilibre entre deux phénomènes qui se déroulent à contresens. La diffusion massique doit être suffisante pour qu'il y ait toujours, près de la flamme, de l'oxydant et du combustible en quantités requises. Aussi, la diffusion thermique, qui apparaît à cause du gradient de température consécutif au dégagement de chaleur de la réaction, ne doit pas être trop efficace, sinon la température des gaz près de la flamme risque d'être trop basse pour que la cinétique de la réaction soit bonne.
L'écoulement turbulent
Dans la réalité, deux gaz ne se trouvent pas accolés, il y a injection de l'un dans l'autre, ou, plus couramment, injection parallèle du combustible et du comburant. Les vitesses d'injection des deux gaz n'étant pas obligatoirement les mêmes, il va se produire un cisaillement mécanique à l'interface des deux fluides, et des tourbillons vont se développer : l'écoulement devient turbulent. La flamme est alors enroulée, étirée, jusqu'à l'extinction.
Une étude simultanée de la chimie (cinétique des nombreuses réactions élémentaires) et de la physique (mécanique des fluides compressibles en écoulement turbulent) doit être menée pour pouvoir prévoir les vitesses et les débits d'injection qui permettent d'assurer une combustion complète.
Pour reprendre l'exemple du bec Bunsen, en cas de débit d'air insuffisant à l'admission, du gaz combustible resterait imbrûlé s'il ne se développait une flamme de diffusion, caractérisée par le panache rougeâtre qui se développe au détriment de la zone bleue (le panache est également observé avec un débit d'air convenable, mais il est alors peu important et il est le siège de réactions de recombinaison). La combustion dans un moteur-fusée et dans un feu de bois est celle de flammes de diffusion.

Qu'elle soit de prémélange ou de diffusion, une flamme est généralement visible, car il s'y produit des émissions de lumière. La couleur permet de juger de la concentration des différents corps en présence, en particulier des radicaux chimiques intermédiaires, qui sont caractérisés par des raies d'émission très précises (→ spectre).
Une flamme est également bruyante, car elle oscille avec une certaine fréquence. Cela se produit lorsqu'il y a résonance entre la combustion elle-même et la chambre de combustion et entre les écoulements d'injection des combustibles et des comburants. Ce bruit est une preuve d'instabilité pouvant conduire à l'extinction.
4. Les dangers de la combustion
Les principaux rejets polluants de la combustion sont NO, CO, SO2, SO3, C et les hydrocarbures imbrûlés. De grands espoirs sont placés dans des diagnostics optiques qui permettraient de détecter ces corps dans les fumées industrielles, en remplacement des méthodes de prélèvements actuellement employées.

Les fiouls les plus polluants étant aussi les moins onéreux, une législation stricte de leur utilisation doit aller de pair avec une recherche fondamentale. S'ajoutant au risque d'explosion provoquée par une simple étincelle dans un milieu où les concentrations correspondent au domaine d'inflammabilité explosive, l'incendie est le danger essentiel encouru non seulement lors de l'utilisation du combustible, mais aussi lors de son transport et de son stockage.
La lutte contre l'incendie dépend du type de foyer rencontré. L'eau peut être employée contre des feux secs (bois, papier, tissus). Pour lutter contre les feux gras (hydrocarbures), l'eau est à proscrire, sauf éventuellement sous forme pulvérisée dans certaines conditions : il est préférable d'employer des extincteurs à carbures halogénés (CH3Br), qui étouffent les flammes grâce à l'avidité d'oxygène des molécules projetées, des mousses (émulsion de CO2 dans de l'eau) ou des poudres (NaHCO3).
Contre un feu électrique (sec ou gras à proximité d'une ligne électrique), il ne faut pas, là non plus, employer d'eau, car celle-ci a une conductivité électrique élevée.
Pour en savoir plus, voir l'article risques naturels et technologiques.



















