eau
(latin aqua)


Corps liquide à la température et à la pression ordinaires, incolore, inodore, insipide, dont les molécules sont composées d'un atome d'oxygène et de deux atomes d'hydrogène.
- Glace à 0 °C : 1,091
- Liquide à 0 °C : 1,000 132
- Liquide à 4 °C : 1,000 000
- Indice de réfraction : n20 = 1,333 00
- Chaleur de formation à 25 °C (ΔG0) : −56,69 kcal/mole
- Produit ionique à 25 °C : 10−14
Volumes massiques (l/kg)
CHIMIE

L'eau contient en solution ou en suspension toutes sortes d'autres corps (sels, gaz, micro-organismes, etc.), très répandu à la surface terrestre (eau de pluie, eau de mer, eau du robinet, etc.).


Considérée par les Anciens comme un élément, l'eau est une combinaison d'hydrogène et d'oxygène. Henry Cavendish reconnut en 1781 qu'elle se formait dans la combustion de l'hydrogène. Les travaux d’Antoine Laurent de Lavoisier, de Pierre Simon Laplace et de Jean-Baptiste Marie Meusnier, complétés par ceux d’Anthony Carlisle et de William Nicholson (analyse électrolytique de l'eau, 1800), de Louis Joseph Gay-Lussac et d’Alexander Humboldt (synthèse eudiométrique, 1805), et enfin par ceux de Jean-Baptiste Dumas (synthèse pondérale, 1843), établirent sa composition.
1. La structure de l’eau
1.1. La molécule d'eau
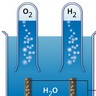
Dans la molécule H2O, chaque atome d'hydrogène est lié à l'atome d'oxygène par une liaison dite « covalente », c'est-à-dire qu'une paire d'électrons est mise en commun, ce qui confère une très grande stabilité à la molécule. Celle-ci se manifeste dans la valeur élevée de l'enthalpie de la liaison O―H (462,5 kJ. mol−1).
Chaque liaison O―H mesure 0,96 Å (1 Å = 10−10 m) et l'angle HOH est voisin de 105 °.
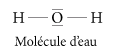
1.2. La polarité de la molécule d'eau
La répartition des charges dans la liaison O–H n'est pas symétrique : les électrons sont plus fortement attirés vers l'atome d'oxygène que vers celui d'hydrogène. Ainsi, la molécule H2O est polaire : elle se comporte comme un dipôle électrique permanent formé par deux charges électriques égales et de signes opposés séparées l'une de l'autre, la charge positive étant localisée au voisinage des atomes d'hydrogène, la charge négative au voisinage de l'atome d'oxygène. Il en résulte des propriétés électriques particulières.
Cette polarité se mesure expérimentalement par de nombreuses caractéristiques électriques, comme le moment dipolaire (1,85 D) ou la constante diélectrique statique (ε = 78 à 25 °C). Aussi, la molécule d'eau est en interaction électrostatique avec toute particule chargée (ion, molécule polaire), et en particulier avec les autres molécules d'eau à l'état solide ou liquide. Cela explique en partie les propriétés de solvant ionisant de l'eau et sa structure condensée.

Le dipôle eau va donc s'orienter dans un champ électrique. Dans un champ alternatif de fréquence convenable (1 à 100 GHz), les dipôles sont soumis à un mouvement d'oscillation qui produit de la chaleur. Ce phénomène est d'ailleurs à la base de la technique de chauffage par micro-ondes des aliments.
1.3. Les liaisons hydrogène dans l'eau en phase condensée
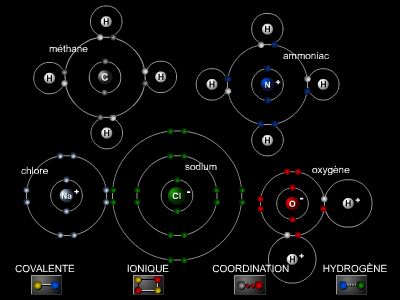
Les molécules d'eau en phase condensée ne sont plus isolées, mais associées pour former de petits amas transitoires (état liquide) ou des structures permanentes et infinies à trois dimensions (état solide ou cristallin). Dans tous ces édifices, deux molécules d'eau voisines sont liées par une liaison particulière dite « liaison hydrogène » (→ matière).
Pour en savoir plus, voir l'article état [physique].
La liaison hydrogène peut être définie schématiquement comme une attraction électrostatique entre une charge négative localisée sur l'oxygène et une charge positive portée par un atome d'hydrogène d'une molécule d'eau voisine.
Ainsi, dans la glace ordinaire, de type I, cette liaison est linéaire, c'est-à-dire que les groupes ―O et HO― impliqués dans ce type de liaison sont alignés avec une distance entre les atomes d'oxygène de 2,76 Å (au point de fusion, 0 °C). Chaque molécule est ainsi reliée à trois autres dans une géométrie tétraédrique.
Cette liaison, d'une énergie de 19 kJ . mol−1, qui est beaucoup plus facile à rompre que la liaison covalente, a cependant une influence sur les propriétés thermodynamiques anormales de l'eau. En effet, à la pression atmosphérique normale, les températures de changement d'état de l'eau – fusion à 0 °C, vaporisation à 100 °C – sont élevées par rapport à celles d'autres composés chimiques de même poids moléculaire, car la rupture de la liaison hydrogène nécessite une agitation thermique importante.
Pour en savoir plus, voir l'article énergie chimique.
1.4. Les différentes masses moléculaires de l'eau
Eau lourde
En 1931 fut découvert par Harold Urey un premier isotope de l'hydrogène, le deutérium D (ou 2 H), deux fois plus lourd que l'hydrogène ordinaire et qui, combiné à l'oxygène dans la même proportion, constitue la molécule D2O, dite « eau lourde ».
Elle est formée de molécules d'eau dont les atomes d'hydrogène ont été remplacés par un isotope de l'hydrogène qui contient un proton et un neutron et que l'on appelle deutérium, de symbole D. De densité 1,106, l’eau lourde se solidifie à 3,82 °C et bout à 101,42 °C. L'eau naturelle contient 0,15 % d'oxyde de deutérium. L'eau lourde est principalement obtenue :
– par électrolyse, l'hydrogène étant libéré plus vite que le deutérium ;
– par distillation fractionnée de l'eau naturelle ;
– par échange isotopique, en tirant profit des petites différences de réactivité entre l'hydrogène et le deutérium ;
– par distillation fractionnée de l'hydrogène naturel liquide. Cette dernière méthode est la plus efficace et la moins onéreuse.
L'existence d'un second isotope de l'hydrogène, le tritium T (3H), radioactif, et aussi de trois isotopes de l'oxygène (16O, 17O, 18O) fait que l'eau est constituée de molécules de masses très variées. L'eau lourde a, comme l'eau, la propriété de ralentir les neutrons par collisions élastiques, mais son pouvoir de capture est inférieur ; de ce fait, elle est utilisée comme modérateur dans certains types de réacteurs nucléaires.
Les variations des rapports isotopiques sont de précieux témoins car, l'abondance de l'isotope 18O diminuant avec le temps, elles fournissent des indications sur l'origine de l'eau et sur son âge.
Eau oxygénée

Découverte en 1818 par Louis Jacques Thenard, l'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2. Pur, ce dernier corps est un liquide sirupeux, incolore, à saveur métallique, de densité 1,46, pouvant se congeler à − 1 °C. Il est soluble dans l'eau en toutes proportions. On trouve dans le commerce l'eau oxygénée à 2 ou 3 % (dite à 10 ou 12 volumes, car elle peut libérer de 10 à 12 fois son propre volume d'oxygène).
Elle est douée de propriétés oxydantes, d'où son emploi comme antiseptique et décolorant. Sa préparation industrielle utilise surtout le procédé à l'anthraquinone.
2. Propriétés physiques et chimiques de l’eau
2.1. Propriétés physiques de l’eau
Généralités
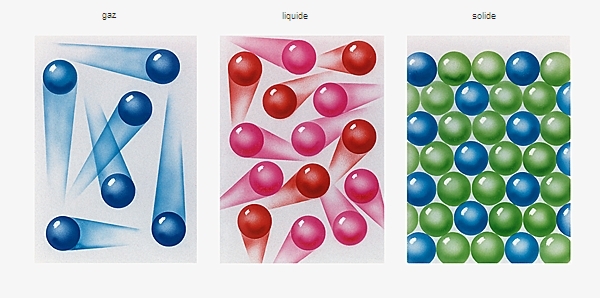
La plus manifeste des propriétés originales de l'eau est celle de ses trois états (gazeux, liquide, solide), de poids spécifiques différents, qui peuvent voisiner : ainsi, sous un ciel chargé de nuages, il n'est pas rare de voir couler un fleuve au milieu d'espaces couverts de neige ou de glace. En outre, et contrairement à beaucoup de substances plus lourdes sous forme solide que sous forme liquide, un bloc de glace est plus léger qu'un égal volume d'eau : 1 l d'eau donne 1,091 l de glace en se solidifiant à 0 °C. Il en résulte que la glace, dont la structure est relativement peu compacte, flotte sur l'eau.

En effet, si l'eau à l'état solide compte près de dix formes cristallines différentes, dans la structure la plus courante, le type I, chaque molécule est liée à ses quatre voisines par des liaisons hydrogène. Cette structure présente des lacunes, ce qui explique sa plus faible masse volumique par rapport à l'eau liquide. Cette propriété explique que la glace ne se forme qu'à la surface des mers et des lacs.
Les propriétés thermiques de l'eau
Une autre originalité de l'eau concerne sa chaleur spécifique. Elle est tellement élevée par rapport à celle des autres corps (18 cal . mol−1 . degré−1) qu'elle a été prise comme référence calorifique : la calorie est la quantité de chaleur nécessaire, à la pression ordinaire, pour porter de 14,5 à 15,5 °C la température de 1 g d'eau.
La chaleur latente de fusion (chaleur nécessaire pour fondre 1 g de glace) est très importante : 83 calories par gramme ; mais la chaleur de vaporisation (chaleur nécessaire pour vaporiser 1 g d'eau) l'est plus encore : 600 calories par gramme.
L'eau possède, en conséquence, une forte inertie thermique et, sous toutes ses formes, sa présence amortit les variations de température (son influence est modératrice sur les climats). Elle est également un excellent agent de transport et de conservation de la chaleur.
Tension superficielle de l'eau
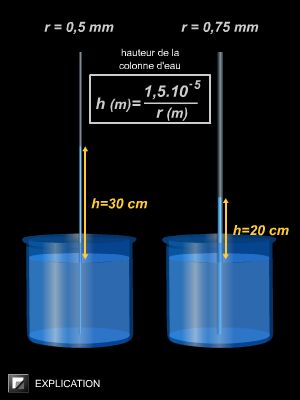
La très forte tension superficielle de l'eau (72 dyn . cm−1) explique ses mouvements de bas en haut, par capillarité, dans le sol et dans les plantes : l'adhérence des molécules d'eau entre elles autorise ce défi aux lois de la pesanteur.
2.2. Propriétés chimiques de l’eau
L’eau solvant
L'eau dissout un grand nombre de substances solides, liquides ou gazeuses. C'est un bon solvant des électrolytes et un mauvais solvant des composés non polaires (hydrocarbures). Ainsi, du fait de sa très grande capacité diélectrique, l'eau est, de tous les liquides connus, le plus proche d'un solvant universel et inerte.
Un autre résultat de sa structure, l'effet hydrophobe – c’est-à-dire le rejet, par les molécules d'eau, des groupements hydrocarbonés CH est de grande conséquence sur la structure même des êtres vivants (protéines, ADN, bicouches lipidiques des membranes cellulaires), qui serait instable en l'absence d'eau.
Une molécule amphotère
Possédant à la fois des propriétés oxydantes et réductrices (→ oxydoréduction), la molécule d'eau est une molécule amphotère : c'est l'acide du couple H2O, OH− et la base du couple H+, H2O ou, mieux, H3O+, H2O (→ acides et bases).
Par ailleurs, l'eau donne de nombreux composés d'addition : hydrates ou complexes.
ÉCOLOGIE
1. État naturel de l'eau
1.1. L’eau sur la Terre
L’eau est présente sur la Terre sous ses trois états : liquide (la Terre est la seule planète du système solaire à posséder de l’eau liquide), à la surface et sous terre, solide (neige et glace), aux pôles, dans les glaciers et au sommet des montagnes, et sous forme de vapeur d’eau, dans l’atmosphère. De l’eau liquide est également contenue dans tous les êtres vivants ; elle est indispensable à la vie (et c’est dans l’eau que celle-ci est apparue, il y a plus de 3,8 milliards d’années).

Le volume total de l’eau présente sur la Terre, sous toutes ses formes, souterraine, en surface ou dans l’atmosphère, constitue l’hydrosphère. Il représente près de 1,4 milliards de km3. Pour 97,2 %, l’hydrosphère est constituée par les mers et les océans, qui couvrent presque les trois-quarts (72 %) de la surface de la Terre et lui donnent, vue de l’espace, la couleur bleue qui lui a valu le nom de « planète bleue ». L’ensemble des eaux douces (à peine 2,8 % de l’eau totale) est estimé à environ 39 millions de km3. L’essentiel de ces eaux est immobilisé sous la forme de glaces (29 millions de km3), essentiellement dans les calottes glaciaires de l’Antarctique et du Groenland (qui couvrent une superficie supérieure à 17 millions de km2 de terre, sur une épaisseur moyenne de plus de 1,5 km). Le reste se répartit en eaux souterraines (9,5 millions de km3), et eaux de surface : lacs et mers intérieures (125 000 km3), humidité des sols (65 000 km3), fleuves et rivières (1 700 km3), auxquelles il faut ajouter l’eau de l’atmosphère (environ 13 000 km3 d’eau) – une quantité destinée à augmenter en raison du réchauffement climatique. L’eau contenue dans les êtres vivants représenterait environ 1 100 km3. (Ces chiffres sont des estimations ; divers travaux ont été publiés sur cette question, c’est pourquoi l’on en rencontre d’autres, différents mais néanmoins proches et respectant peu ou prou les mêmes proportions).
On appelle parfois eau bleue l’ensemble des eaux des lacs, fleuves, rivières, nappes phréatiques, glaciers, et eau verte l’eau contenue dans les sols et disponible pour les plantes (et indirectement les animaux). Au final, l’eau douce disponible et accessible pour l’homme (cours d’eau, lacs, barrages, nappes souterraines peu profondes, récupérateurs d’eau de pluie...) représente moins de 1 % du total de l’eau de la planète, ce qui correspond à – seulement – 0,028 % de l’hydrosphère.
1.2. Le cycle de l’eau
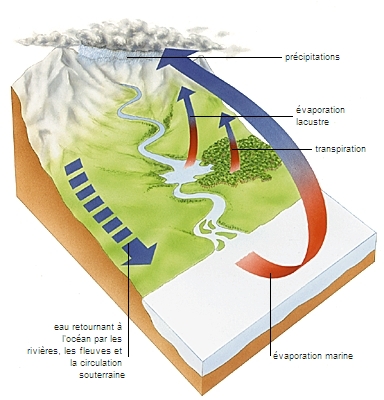
Le volume total de l’eau sur la Terre (l’hydrosphère) est en perpétuel mouvement et circule en permanence entre ses différents réservoirs (à la surface de la planète, dans l’atmosphère et dans le sous-sol) : c’est ce que l’on appelle le cycle de l’eau.
L’eau séjourne dans ses différents réservoirs plus ou moins longtemps. Ainsi, il faut jusqu’à 9 700 ans pour que soit entièrement renouvelée l’eau des calottes glaciaires, mais 2 500 pour les océans, 17 ans pour les lacs d’eau douce, 16 jours pour les cours d’eau et 8 jours pour l’atmosphère.
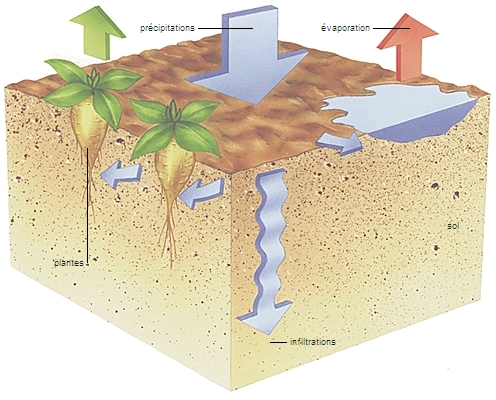
Provoquée par le rayonnement solaire, l'évaporation soustrait à tout moment de l'eau liquide aux océans (1 000 km3 par jour), aux lacs, aux rivières, aux surfaces humides, ainsi qu'aux sols et aux plantes (on parle plus précisément, dans ce dernier cas, d’évapotranspiration). La vapeur d'eau s'élève et circule, comme un gaz, dans l'atmosphère, où elle se condense au contact d'un air plus froid et donne naissance aux nuages. Dans certaines conditions et par l'effet de la pesanteur, cette eau regagne la surface des continents et des océans sous forme de précipitations (pluie, neige, grêle). Parvenue au sol, une grande partie (61 %) s’évapore ; le reste ruisselle (16 %) et rejoint les cours d’eau, ou pénètre dans le sol (23 %) où elle circule et alimente les nappes et les rivières souterraines. Ces flux souterrains hydratent les couches superficielles du sol, alimentent et renouvellent les nappes profondes, nourrissent les sources, soutiennent la vie des plantes, par lesquelles une partie de l'eau remonte dans l'atmosphère en changeant à nouveau d'état.
Drainées par les cours d'eau ou les langues glaciaires aux hautes latitudes, les eaux continentales, après des trajets fort divers, finissent à la mer pour se mêler aux immenses réserves océaniques.
Le moteur du cycle de l’eau est le Soleil : c’est en fonction de l’énergie qu’il envoie sur Terre que l’eau s’évapore ou précipite, que les glaces fondent ou non, etc. Le cycle de l’eau a un impact sur le modelage de la surface de la Terre : érosion (par les rivières, les pluies, les glaciers), remplissage variable des cours d’eau et des plans d’eau...
1.3. Le bilan de l’eau
L'estimation des quantités d'eau entraînées dans le cycle de l'eau, en une période donnée, constitue le bilan, première tâche que se fixent les hydrologues. Il implique l'évaluation des apports et des restitutions d'eau ainsi que le calcul de la vitesse à laquelle se renouvellent les aquifères, et ce à n'importe quelle échelle d'espace et de temps.
Le bilan peut en effet porter sur le système global de la circulation terrestre ou sur toute autre fraction de l'ensemble, par exemple un continent, une région, un pays, un champ, un bassin-versant de quelques hectares comme celui qui s'étendrait sur des millions de kilomètres carrés… Le bilan peut de même avoir pour cadre temporel l'année, la saison, le mois, quelques jours, quelques heures ou même moins. On appelle bilan hydrologique celui réalisé à l’échelle d’un bassin-versant, bilan hydrique celui étudiant les mouvements de l’eau à l’échelle d’une parcelle agricole ou même d’une simple plante.
À l'échelle mondiale et au cours d'une année, le volume estimé de l’eau entraînée dans le cycle équivaut à une lame d'eau de 1 m d'épaisseur qui serait répartie uniformément sur toute la surface terrestre, volume énorme de quelque 500 000 km3 – relativement faible pourtant quand il est comparé au stock hydrique total, qui envelopperait la Terre d'une couche d'eau épaisse de 3 km ! Les précipitations annuelles sur la planète représentent environ 1,1 million de km3.
1.4. La qualité des eaux naturelles
S'il n'y a pas de différence essentielle entre les eaux rencontrées dans la nature – il s'agit toujours de la même substance –, leur qualité est aussi variable que les éléments de l'environnement où elles circulent.
Des eaux très différentes
Elles diffèrent par leur goût, leur odeur, leur couleur, leur température, leur acidité. Même l'eau de pluie contient quelques particules de sels dissous qui ont été transportées par le vent soufflant au-dessus des continents ; elle est aussi quelquefois chargée de poussières et de gaz dissous, ainsi que de substances polluantes (c’est notamment le cas des pluies acides). Certaines sources sont connues pour leurs propriétés minérales particulières. Des forages proches dans une même nappe fournissent parfois des eaux différentes. L'eau des rivières peut être claire ou turbide. Quant aux eaux superficielles courantes ou stagnantes et aux eaux souterraines, leur qualité varie d'un lieu à l'autre selon la nature du sol et du substratum rocheux, le climat, la saison, le niveau de pollution, l'activité biologique d'organismes vivants qui la peuplent, y vivent, y meurent et s'y décomposent.
Les éléments minéraux, présents à des concentrations plus ou moins élevées, sont les mêmes dans les eaux provenant des aquifères souterrains ou de surface (rivières, lacs, retenues de barrages).
Les eaux souterraines
La filtration au travers de terrains poreux, l'obscurité et la raréfaction de l'oxygène dans les profondeurs du sol, ainsi que l'atténuation des variations de température confèrent aux eaux souterraines des qualités distinctes de celles des eaux superficielles. ces dernières sont, en général, plus turbides, plus colorées, moins minéralisées, plus riches en matières organiques, plus exposées aussi aux principales pollutions d'origine humaine. Mieux protégées des pollutions car elles sont filtrées par les couches de terrains et de roches qu’elles traversent lors de l'infiltration, les eaux souterraines n'en sont toutefois pas complètement préservées. Si la pollution les gagne, elle est toujours grave, tant à cause de la quantité d'eau contaminée que de la longue durée nécessaire au renouvellement de la réserve.
Par ailleurs, en agissant sur les roches, dont elles dissolvent les éléments solubles, les eaux souterraines se minéralisent. Selon la proportion des sels dissous, ces eaux sont dites douces (moins de 0,6 g de sels par litre) ou dures. Les eaux minérales contiennent une notable proportion de sels minéraux utilisables en thérapeutique.
Les paramètres caractéristiques de la qualité de l'eau
Quelques paramètres sont jugés suffisants pour caractériser l'ensemble des altérations physiques et biochimiques : la charge des matières en suspension (MES), en matières oxydables (MO) et en oxygène dissous, la teneur en nitrates, en phosphore et en chlorophylle, l'indice biologique global (IBG).
La charge en matières oxydables est mesurée par les demandes biologiques (DBO 5) et chimiques (DCO) en oxygène. La raréfaction de ce gaz indispensable à l'équilibre biologique des milieux aquatiques, notamment par élévation, naturelle ou non, de la température de l'eau, peut provoquer la mort d'êtres vivants qui l'habitent.
Une forte DBO 5 est l'indice de fertilité du milieu et d'une active biodégradation des matières organiques. Si les bactéries aérobies, réductrices, viennent à manquer d'oxygène, la décomposition anaérobie des matières organiques accumulées provoque le dégagement de gaz et de substances toxiques. L'introduction dans l'eau de nutriants (principalement des nitrates et des phosphates) accélère donc un processus naturel d'eutrophisation, qui est devenu une forme de pollution des plus répandues et des plus tenaces. L'excès de phosphore – substance nécessaire à la vie à doses modérées – est ainsi la cause principale des proliférations d'algues dans les eaux continentales et littorales, et à l'origine indirecte de toxines.
Pour en savoir plus, voir l'article traitement des eaux.
1.5. L'eau de mer
On définit la salinité de l'eau de mer par sa teneur en sels dissous, exprimée en ‰, c'est-à-dire en grammes par kilogramme d'eau de mer. Si la salinité des eaux océaniques varie avec les régions, leur composition en revanche reste sensiblement constante, si l'on ne tient pas compte des eaux côtières ; soit, pour 1 kg d'eau de mer à 35 ‰, 27,3 g de chlorure de sodium, 3,4 g de chlorure de magnésium, 2 g de sulfate de magnésium, 1,3 g de chlorure de calcium, 0,6 g de chlorure de potassium, 0,1 g de carbonate de calcium. La majeure partie de ces sels se trouve à l'état ionisé, et l'excès de cations donne à l'eau de mer un caractère alcalin (pH compris entre 7,5 et 8,4) dont les variations, inversement proportionnelles à leur teneur en gaz carbonique, jouent un rôle prépondérant en biologie marine.
La salinité des eaux océaniques superficielles varie avec la latitude en fonction de l'évaporation et des précipitations : 34,5 ‰ dans les régions équatoriales, de 36 à 37 ‰ aux moyennes latitudes, 34 ‰ dans les régions polaires.
L'eau de mer est également définie par sa température, très variable en surface en fonction de l'éclairement solaire et des échanges de chaleur entre l'océan et l'atmosphère : elle varie entre 1,9 °C, dans les régions polaires et + 30 °C environ dans les régions tropicales. En profondeur, en revanche, la température varie très peu (entre 0 °C et 4 °C).
La température et la salinité d'une eau océanique permettent de déterminer sa densité. On définit ainsi des masses d'eau bien particulières dont on peut suivre les mouvements (ce sont les grands mouvements océaniques) grâce à l'étude des courbes de température et de salinité, appelées diagrammes T-S.
Une autre propriété de l'eau de mer est sa couleur. Le bleu est dû à l'absorption plus rapide des radiations rouges que des radiations bleues par l'eau de mer. La couleur verte que l'on observe dans les régions côtières est due à la présence de plancton et de particules minérales provenant de l'érosion littorale. La moitié de la lumière est absorbée à 1 m de profondeur, et plus de 90 % au-delà de 1 m de profondeur.
Les ondes sonores, enfin, se propagent beaucoup plus rapidement dans l'eau que dans l'air et présentent un intérêt considérable pour la navigation maritime et pour l'océanographie.
2. L'eau et les organismes vivants
L'eau est le milieu de vie de tous les animaux ou plantes aquatiques. Mais elle constitue aussi l'élément principal de toutes les cellules en état de vie active, y compris sur la terre ferme. Enfin, chez les êtres de grande taille, elle forme l'essentiel du liquide circulant (sève des plantes, sang des animaux).
2.1. L'eau en tant que milieu
Les eaux diffèrent par leur salinité (la teneur en sel définissant les eaux douces, saumâtres et salées), leur température, leur éclairement, leur mouvement (eau circulante ou eau stagnante), leur teneur en oxygène, etc. Pour chacun de ces facteurs, certaines espèces animales ou végétales supportent d'importants écarts alors que d'autres exigent des conditions constantes. En outre, tous les intermédiaires existent entre les êtres aquatiques stricts (méduses, poissons, plantes aquatiques...) qui meurent rapidement hors de l'eau et les animaux qui ne passent dans l'eau que leur vie larvaire (moustiques, libellules, grenouilles...) ou les algues ou les coquillages du littoral, longuement émergés à chaque marée basse.
2.2. L'eau en tant que constituant du vivant
L’eau est le constituant essentiel des cellules. Elle est le milieu dans lequel s’effectuent toutes les réactions biochimiques et assure le transport des protéines, des sels minéraux, des vitamines hydrosolubles.
Chez les plantes terrestres, c'est l'eau qui assure la turgescence, c'est-à-dire la pression intérieure qui donne aux cellules leur volume et leur fermeté. Ainsi la perte d'eau entraîne-t-elle la fanaison, puis la mort.
Les animaux sont également dépendants de l’eau pour survivre. Or, en milieu terrestre, l'air est rarement humide à saturation et l'évaporation risque toujours d'excéder l'alimentation en eau. D'où l'importance et la diversité des dispositifs de rétention de l'eau : réduction des surfaces susceptibles de permettre l’évaporation, existence de carapaces ou de coquilles, activité nocturne, voire entrée en vie ralentie (c’est le cas par exemple de certains poissons dipneustes, qui s’enferment pendant la saison sèche dans un cocon de boue au fond des lacs et des rivières asséchés).
2.3. L'eau en tant que liquide circulant
Le pouvoir solvant de l'eau à l'égard de la plupart des substances vitales : oxygène, gaz carbonique, minéraux, glucose, acides aminés, etc., fait d'elle le meilleur support pour la distribution de ces substances à tout un organisme, sous la forme des sèves brute et élaborée chez les plantes, du sang chez les animaux. Très fluide, l'eau circule dans les vaisseaux à faible coût énergétique et elle peut véhiculer des particules solides telles que les globules du sang.
2.4. L’eau chez l'homme adulte
Le corps humain est constitué en moyenne de 60 % d'eau, diversement répartie. À titre d’exemple, un homme adulte de 70 kg renferme 45 l d’eau. Mais la teneur en eau varie selon l’âge (de 75 % chez un nourrisson à environ 50 % après 50 ans), le sexe (elle est plus élevée chez l’homme que chez la femme) et les organes étudiés (elle représente ainsi 90 % du plasma du sang, mais seulement 1 % de l’ivoire des dents).
L’eau du corps est répartie en deux grands compartiments liquidiens :
L'eau extracellulaire, qui représente environ 40 % de l'eau totale, correspond au plasma, à la lymphe, au liquide céphalorachidien et aux liquides interstitiels baignant les cellules.
L'eau intracellulaire, c'est-à-dire incluse dans les cellules, représente 60 % de l'eau totale de l'organisme.
L'eau circule d'un secteur à l'autre en fonction des concentrations existant respectivement de part et d'autre de la membrane cellulaire. Elle permet le transport des diverses substances qu'elle renferme en solution et les réactions chimiques entre elles. Par son fonctionnement, l'organisme humain perd en moyenne 2,5 litres d'eau par jour, principalement par les urines – ces pertes étant régulées par les reins (sous l'effet de l'hormone antidiurétique) –, le tube digestif (selles), les poumons (expiration) et la peau (transpiration). Les pertes organiques en eau doivent être compensées par un apport correspondant : eau de boisson (environ 1,5 l d’eau par jour pour un organisme adulte ne fournissant pas d’effort physique particulier) et eau contenue dans les aliments (1 l). Le métabolisme de l'eau est régulé par l'organisme.
La déshydratation correspond à une teneur en eau insuffisante ; la soif est le premier signal indiquant un déficit en eau. Sans aucun apport d’eau par la nourriture ni la boisson, un homme adulte survit 2 à 3 jours maximum). À l'inverse, lors d'une sécrétion trop importante d'hormone antidiurétique, l'organisme a tendance à retenir trop d'eau, ce qui peut provoquer la formation d'œdèmes, en particulier d'œdème cérébral, susceptible d'entraîner des troubles de la conscience, voire un coma.