liaison chimique

Interaction entre atomes différents ou identiques qui conduit à la formation d'agrégats permanents (composés chimiques, corps simples polyatomiques, etc.).
CHIMIE
Introduction
La plupart des atomes s'associent pour acquérir une situation stable dans leur environnement. En mécanique, un solide ne peut être placé n'importe où ; sous l'influence de champs de forces, il se déplace, s'il est libre de ses mouvements, jusqu'à trouver une position stable.
De façon analogue, un atome A, parce qu'il est fait de particules chargées, crée autour de lui des champs de forces électriques que subira tout autre atome, identique (A) ou différent (B), qui approchera. On peut concevoir que deux atomes puissent s'attacher l'un à l'autre pour acquérir ensemble une structure plus stable que s'ils restaient séparés: on parle alors d'une liaison entre deux atomes.
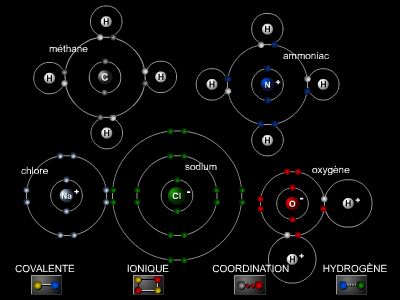
On distingue schématiquement trois types de liaisons fortes – énergie de liaison supérieure à 100 kJ.mol−1 – (liaisons ionique, covalente, métallique), et deux types de liaisons faibles (liaison de Van der Waals et liaison hydrogène). Cependant, la liaison réelle fait souvent intervenir plusieurs types de liaisons à la fois, selon la nature des espèces chimiques mises en jeu.
Les liaisons fortes
La liaison ionique
La liaison ionique unit par attraction électrostatique des ions de signes contraires. Dans le cas du chlorure de sodium Na+Cl− par exemple, la formation simultanée des ions est due au transfert d'un électron de l'atome de sodium vers l'atome de chlore ; le sodium prend la structure électronique stable du gaz rare de plus proche (le néon) et le chlore prend celle de l'argon (→ élément). Les cristaux ioniques fondus ou en solution dans l'eau sont ainsi des liquides conducteurs et électrolysables.
La liaison covalente ou atomique
La majorité des solides et des gaz n'étant pas électrolysables, ils sont constitués d'atomes ou de molécules neutres, unis par liaison de covalence ou liaison atomique (Lewis, 1916). Cette liaison résulte de la mise en commun de deux électrons (doublet) par chacun des deux atomes, qui acquièrent ainsi la structure électronique plus stable du gaz rare le plus proche. Par exemple deux atomes de chlore Cl établissant une liaison de covalence (notée : ―) prennent tous deux la structure électronique de l'argon : Cl―Cl. La liaison covalente peut aussi être formée avec deux ou trois doublets (liaison double : C=C ; liaison triple : C≡C).
La liaison « semi-polaire » est une liaison covalente dans laquelle le doublet est fourni par un atome, dit « donneur » à un « accepteur » disposant d'une place libre pour le doublet.
Dans certains composés, les liaisons covalentes ne sont pas toutes localisées ; dans le benzène, par exemple, chacun des 6 atomes de carbone donne un électron pour former une liaison délocalisée (liaison π), répartie sur l'ensemble du cycle.
La liaison métallique
La liaison métallique est l'exemple d'une délocalisation – non plus à l'échelle d'une molécule – mais d'un cristal tout entier. Les électrons de valence se déplacent librement parmi les cations qui forment les nœuds du réseau cristallin et assurent, par leur interaction avec ces derniers, la forte cohésion du cristal.
Les liaisons faibles
D'autres types de liaison existent, qui sont nettement moins fortes que les précédentes. Dans une molécule d'eau, deux atomes d'hydrogène sont liés par deux liaisons covalentes à un atome d'oxygène. Les molécules d'eau sont liées les unes aux autres dans l'eau liquide : si elles ne l'étaient pas, les molécules seraient séparées et l'on aurait un gaz. Le fait qu'à 25 °C l'eau soit liquide prouve qu'il existe des liaisons entre elles. À la même température, l'octane (C8H18) est également un liquide: les molécules sont attirées les unes par les autres.
La liaison par forces de Van der Walls
Les forces responsables de ce type de liaison intermoléculaire, appelées forces de Van der Waals, sont bien plus faibles que celles qui assurent la cohésion d'une molécule, d'un solide ionique ou d'un métal. Elles s'exercent sur des distances faibles et dérivent d'un potentiel proportionnel à 1/r6 (r étant la distance entre deux molécules). Il est ainsi facile de vaporiser de tels liquides aux pressions ordinaires : l'octane bout à une température relativement basse, ce qui indique que l'énergie (thermique) mise en jeu est faible.
La liaison hydrogène
La liaison hydrogène est un autre type de liaison intermoléculaire. Elle est notamment responsable de la cohésion de la glace et de l'association entre les diverses molécules des protéines. La liaison hydrogène est due au déplacement du doublet liant vers un élément fortement électronégatif (O, F, N), créant ainsi un dipôle dont l'hydrogène est le côté positif ; il peut donc attirer, par liaison électrostatique, le côté négatif d'un autre dipôle.




