carbone
(latin carbo, -onis, charbon)

Non-métal qui constitue l'élément essentiel des charbons et des composés organiques. (Élément chimique de symbole C.)
- Numéro atomique : 6
- Masse atomique : 12,01
- Masse volumique (diamant) : 3,52 g/cm3
- Température de fusion : 3 500 °C
Parmi les variétés allotropiques du carbone, seules sont bien définies les variétés cristallisées, le diamant et le graphite, qui constituent du carbone assez pur. On peut citer aussi les fullerènes, formes de carbone récemment découvertes et faisant l'objet de nombreuses études. Le carbone amorphe se trouve dans les charbons naturels et artificiels. L'anhydride carbonique existe dans l'air, les eaux, les carbonates dans le sol. Les combinaisons avec l'hydrogène, l'oxygène, l'azote entrant dans la constitution des organismes animaux et végétaux, on a donné le nom de « chimie organique » à l'étude des composés du carbone, bien qu'il soit possible de les obtenir par synthèse. Les charbons de terre (anthracite, houille, lignites) proviennent de la décomposition de matières végétales enfouies à des périodes géologiques anciennes. Des charbons artificiels (coke, noir d'acétylène, noir de fumée, charbon de bois, noir animal, etc.) peuvent être obtenus en décomposant par la chaleur, à l'abri de l'air, des substances organiques.
Propriétés physiques
Dans le diamant, les atomes de carbone sont disposés tétraédriquement et sont équidistants les uns des autres, ce qui confère une grande dureté au cristal. Dans le graphite, les atomes sont disposés en couches, où ils forment un réseau hexagonal régulier. Le carbone est utilisé pour ses propriétés conductrices (électrodes de graphite ou de charbons agglomérés), colorantes (peintures et encres à base de noir de fumée), ou absorbantes (charbon végétal activé). Les fibres de carbone, de résistance mécanique très élevée, entrent dans la constitution de matériaux composites. Insoluble dans tous les solvants usuels, le carbone se dissout seulement dans quelques métaux en fusion, le fer notamment.
Enfin, élément léger absorbant peu les neutrons lents, le carbone est utilisé comme réflecteur de neutrons et comme modérateur dans les réacteurs nucléaires ; on l'emploie sous forme de graphite.
Propriétés chimiques
Donnant lieu à une grande diversité de réactions chimiques, le carbone possède généralement la valence 4. Pour représenter les formules des composés organiques saturés, on admet que l'atome de carbone est au centre d'un tétraèdre régulier dont les sommets sont occupés par 4 atomes ou 4 radicaux univalents. (→ stéréochimie.)
L'hydrogène réagit sur le carbone en donnant des hydrocarbures dont beaucoup ont été réalisés par synthèse. Le tétrachlorure de carbone CCl4, obtenu à partir du sulfure de carbone, est très employé comme solvant des corps gras et mène, par action du fluor, aux Fréons. L'oxychlorure de carbone ou phosgène COCl2, obtenu par action directe du chlore sur l'oxyde de carbone, est très employé en synthèse organique.
Le carbone brûle en donnant, selon le cas, du gaz carbonique CO2 ou de l'oxyde de carbone CO. Le soufre réagit en formant du sulfure de carbone CS2, liquide incolore très volatil employé comme solvant, et dans la fabrication de la viscose. L'azote donne naissance à un cyanure. Le silicium et le bore donnent des carbures très durs SiC (abrasif) et B6C. Le carbone se combine à un grand nombre de métaux (le carbure de fer Fe3C est un constituant des fontes ; le carbure de calcium CaC2 sert à préparer l'acétylène). À haute température, le carbone réduit la vapeur d'eau, la plupart des oxydes de non-métaux et des oxydes de métaux, permettant ainsi d'isoler ces corps, ce qui explique son emploi en métallurgie.
Composés oxygénés
Le monoxyde de carbone, CO, découvert par Priestley en 1799, est un gaz incolore et inodore, de densité 0,97. Il est très difficile à réduire en carbone, mais réagit facilement avec l'hydrogène en présence de catalyseurs, en donnant, selon le cas, du méthane, du méthanol ou des mélanges d'hydrocarbures. Il brûle en dégageant beaucoup de chaleur et forme un mélange détonant avec l'air. Il réduit de nombreux oxydes et se combine à de nombreux ions métalliques ou métaux de transition pour donner des métaux-carbonyles. Parce qu'il interdit à l'hémoglobine de jouer son rôle de transporteur d'oxygène et d'anhydride carbonique, c'est un poison redoutable (asphyxies dues à un fonctionnement défectueux des foyers). Dans l'industrie, on le prépare par oxydation du charbon par l'air ou l'eau, puis par liquéfaction fractionnée.
Dioxyde de carbone ou anhydride carbonique → carbonique.
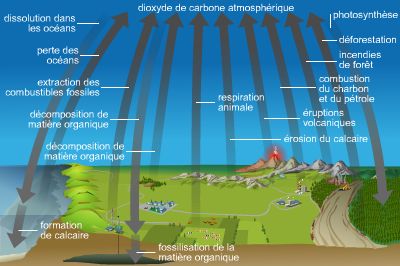
Le cycle du carbone
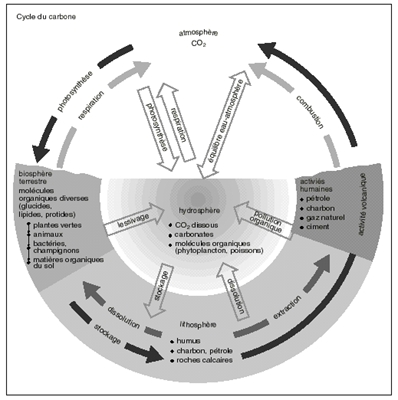
C'est un cycle biosphérique, au cours duquel le carbone en combinaison organique est transmis d'un être vivant à un autre le long des chaînes alimentaires, puis rendu à l'atmosphère sous forme d'anhydride carbonique, que les plantes vertes incorporent par photosynthèse à nouveau dans des composés organiques.
Au principal cycle du carbone, qui se déroule sur terre et dans les eaux, il faut ajouter deux cycles beaucoup plus lents qui impliquent un passage par l'intérieur de la Terre (lithosphère).
1° Le cycle du calcaire, ou carbonate de calcium, issu par exemple de l'enfouissement des coquilles de mollusques et que seule l'activité volcanique peut décomposer en libérant du CO2 atmosphérique au bout d'un temps immense ;
2° le cycle du charbon et du pétrole, dont la combustion par l'homme enrichit, elle aussi, l'atmosphère en CO2. De nos jours, l'ensemble des plantes vertes n'utilise pas la totalité du carbone ainsi dégagé.
Le carbone 14
Produit dans l'atmosphère sous l'influence du rayonnement cosmique, et rapidement oxydé en CO2, le carbone 14 (14C) pénètre, par photosynthèse et métabolisme, dans les organismes végétaux ou animaux, où son activité spécifique reste constante. Dès la mort de la plante ou de l'animal, l'activité du 14C diminue par désintégration radioactive de période 5 730 ans. La mesure précise de l'activité du 14C permet ainsi la datation d'échantillons d'origine animale ou végétale qui ne sont pas trop anciens (quelques dizaines de milliers d'années au plus).
Les fibres de carbone
Les fibres de carbone présentent des caractéristiques thermiques, frictionnelles et mécaniques très intéressantes, associées à une faible densité. Utilisées en renfort de résines ou de métaux, elles permettent de constituer des matériaux composites légers, d'une exceptionnelle rigidité et d'une grande résistance, très appréciés dans divers domaines, l'aéronautique notamment.