énergie chimique
Énergie associée à la liaison des atomes dans les molécules.
Un milieu réactionnel peut absorber ou produire de l’énergie sous différentes formes : mécanique, calorifique, électrique, lumineuse, etc.
Dans les combustions, l’énergie chimique est utilisée et transformée en énergie mécanique, calorifique ou autres. On parle de pouvoir calorifique ou chaleur de réaction rapportée à l’unité de masse de combustible.
Dans les réactions explosives, une grande partie de l’énergie est dégagée sous forme de travail mécanique, le reste sous forme de chaleur ou d’énergie de radiation.
Dans les piles et les accumulateurs, l’énergie chimique produit directement de l’énergie électrique ; au contraire, une réaction d’électrolyse en consomme.
Les corps phosphorescents émettent de la lumière en subissant des transformations chimiques, tandis que l’assimilation chlorophyllienne du gaz carbonique de l’air par les plantes (photosynthèse) ne peut se faire qu’avec absorption d’énergie lumineuse.
L’énergétique chimique comprend donc un grand nombre de branches, dont chacune rend compte des échanges d’une forme donnée d’énergie.
Mesure de l’énergie chimique
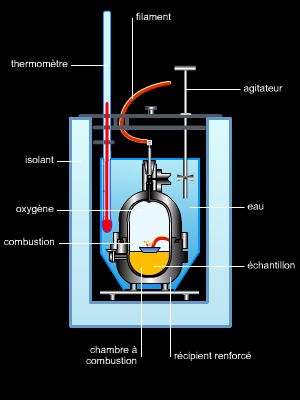
Pour mesurer la quantité de chaleur dégagée (réaction exothermique) ou absorbée (réaction endothermique) au cours d’une réaction chimique, on utilise une bombe calorimétrique si l’on veut étudier ce phénomène à volume constant, et la méthode des mélanges pour l’étude des réactions à pression constante.
Les chaleurs s’expriment souvent en calories, mesure pratique découlant de l’emploi du calorimètre ; toutefois, il vaut mieux les exprimer en joules, unité légale du Système international. Dans de nombreux cas, il est difficile, voire impossible, de mesurer directement ces chaleurs de réaction ; mais la thermochimie permet de les calculer.
Origine de l’énergie chimique
Pour comprendre l'origine de ces chaleurs de réaction, il faut se rappeler qu’une réaction chimique consiste en la réorganisation des atomes constituant les molécules. Or, les atomes sont liés entre eux, dans un cristal ou dans une molécule, par des liaisons « riches en énergie ». La chaleur de réaction est donc le bilan énergétique, à une température T, des destructions et formations des molécules au cours de cette réaction.
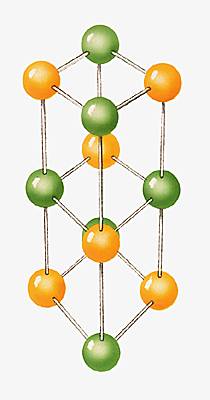
Dans l’exemple du cristal de chlorure de sodium (NaCl) : 6 ions Na+ entourent l’ion Cl– et 6 ions Cl– entourent l’ion Na+ (structure cubique à face centrée). Les atomes électrisés s’attirent et, pour détruire ce cristal, il faut le chauffer, c’est-à-dire lui fournir de l’énergie (l’énergie réticulaire est l’énergie nécessaire à la formation ou à la destruction d'un cristal) :
NaCl → Na+ + Cl–.
Mais il est également possible de dissoudre ce cristal dans l’eau.
Un autre phénomène intervient : la solvatation des ions, c’est-à-dire que des molécules de solvant, ici l’eau, « enveloppent » les ions Na+ et Cl– ; cette réaction est exothermique. La dissolution n’est possible que si l’énergie apportée par la solvatation est au moins suffisante pour disloquer le cristal.
On peut mesurer l’énergie de dissolution dans un calorimètre : elle correspond à la somme des deux précédentes. Elle peut être négative (dissolution exothermique : la température de l’eau va augmenter) ou positive (dissolution endothermique : la température de l’eau va diminuer ; de plus, si l'on chauffe, on favorise la dissolution). Ce n’est pas très sensible pour le chlorure de sodium, mais la dissolution du nitrate d’ammonium peut refroidir l’eau d’une vingtaine de degrés : on l’emploie pour la confection de mélanges réfrigérants.