liquide

État physique de la matière correspondant aux corps qui coulent ou tendent à couler (corps fluides condensés).
PHYSIQUE

Un liquide est caractérisé par sa capacité d’écoulement (fluidité) et n’a donc pas de forme propre : il prend la forme du récipient qui le contient. En revanche, un liquide a un volume propre et présente de ce fait une très faible compressibilité.
1. Propriétés des liquides
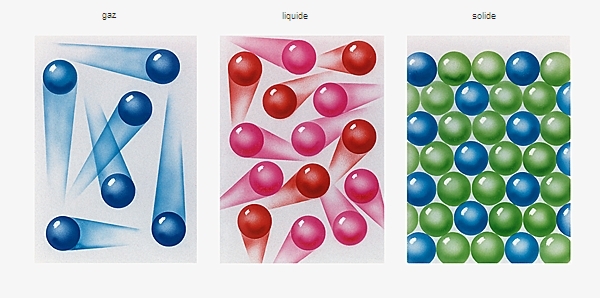
Dans un liquide, la matière est beaucoup plus dense que dans un gaz. En effet, la distance entre molécules est plutôt comparable à celle qui existe dans un solide, mais les forces entre les molécules y sont plus faibles : en fait, à l’état liquide, les molécules sont soumises à une agitation thermique et effectuent ainsi des mouvements aléatoires. En conséquence, les molécules peuvent glisser les unes sur les autres, ce qui confère au liquide sa fluidité, c’est-à-dire sa capacité d’écoulement.
Un liquide est donc une substance compacte partiellement ordonnée. D'après des études aux rayons X, les molécules d'un liquide sont ordonnées à courte distance mais désordonnées à longue distance. Dans certains liquides, les molécules ont une orientation préférentielle, conférant au corps des propriétés anisotropes, c'est-à-dire qui varient selon la direction considérée. Si cette orientation préférentielle engendre un ordre à longue distance, on a alors affaire à des cristaux liquides.

Dans des conditions appropriées de température et de pression, la plupart des substances peuvent exister à l'état liquide. Les liquides peuvent se solidifier (→ solidification) ou s'évaporer (→ évaporation). Certains solides sont toutefois sublimés : ils passent directement de l'état solide à l'état gazeux, sans passer par l’état liquide (→ sublimation). Par exemple, le dioxyde de carbone solide, ou « neige carbonique » se sublime rapidement à la pression atmosphérique à – 78,5 °C et est utilisé comme réfrigérant en laboratoire ou pour produire de la fumée au cinéma.
La densité des liquides est en général inférieure à la densité des mêmes substances à l'état solide : les molécules sont légèrement plus éloignées les unes des autres à l’état liquide. Seule une substance déroge à cette règle : l'eau, dont la densité maximale est atteinte non pas à 0 °C mais à 3,98 °C ; ainsi, la glace est moins dense que l'eau liquide (à l'image d'un glaçon flottant dans un verre d’eau).
2. Caractérisation des liquides
Les liquides sont généralement caractérisés par les grandeurs physiques suivantes : la viscosité, la pression de vapeur saturante, la température d’ébullition ou de congélation, et la chaleur latente de vaporisation.
La viscosité représente la résistance à l'écoulement du liquide, ce qui peut être assimilé aux frottements du liquide sur les surfaces ou aux frottements de différentes couches de liquides entre elles. La viscosité augmente avec la pression et diminue avec la température. La viscosité dépend également de la complexité des molécules du liquide rencontré : elle est faible dans les gaz inertes liquéfiés et élevée dans les huiles lourdes.
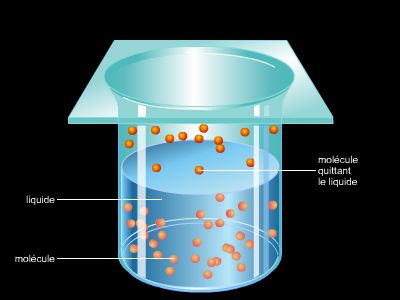
La pression de vapeur saturante est la pression de la vapeur en équilibre avec sa forme liquide. Si la pression d’un tel système est augmentée, une partie du gaz se transforme en liquide et inversement. Cette pression dépend uniquement de la température.
Les points d’ébullition et de congélation (→ solidification) d’un liquide sont respectivement la température à laquelle le liquide s’évapore et celle à laquelle il se solidifie. Notons cependant que certains liquides peuvent être refroidis au-dessous de leur point de congélation, tout en restant liquides : c’est le phénomène de surfusion ; par exemple, l’eau pure peut être liquide (surfondue) jusqu’à – 48 °C.
La chaleur latente de vaporisation représente la quantité de chaleur nécessaire pour transformer un volume donné de liquide en vapeur. Cette caractéristique fondamentale des liquides a été découverte en 1761 par le chimiste et physicien britannique Joseph Black.
3. Tension superficielle et capillarité
La tension superficielle des liquides est une force qui existe à l’interface de deux milieux différents, par exemple l’eau et l’air. Elle explique de nombreux phénomènes tels que la possibilité pour certains insectes de marcher sur l’eau ou qu'une aiguille à coudre puisse flotter à la surface de l'eau.
La tension superficielle a pour origine les forces d'attraction et de répulsion qui s’exercent entre les molécules du liquide (forces intermoléculaires). Si la résultante de ces forces est nulle à l'intérieur d'un liquide, ces forces ne s'annulent pas à la surface et sont dirigées vers l’intérieur de manière à minimiser la surface de contact entre les deux milieux. Ce phénomène, qui se traduit par l’apparition d’une tension de surface caractéristique de chaque liquide, permet notamment d’expliquer la formation des gouttes d’eau (la sphère étant la forme de surface la plus petite possible).
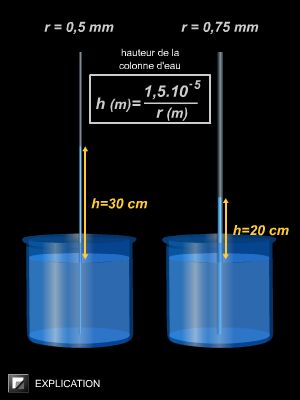
Par ailleurs, la tension superficielle est à l’origine du phénomène de capillarité. Par exemple, dans un tube à essai contenant de l’eau, on observe que l’interface air-eau est bombée vers le bas : la surface forme un ménisque et l’eau remonte le long des parois (car les molécules d’eau sont plus attirées par le verre que par l'air). Selon la valeur de la tension superficielle, le liquide va plus ou moins mouiller les parois latérales. Le phénomène de capillarité est d’autant plus visible que le tube est fin.
Pour en savoir plus, voir l'article mécanique des fluides.








