fer

Métal blanc-gris, tenace, ductile, malléable et magnétique, le plus important pour son utilisation industrielle, surtout sous forme d'alliages, d'aciers et de fontes. (Élément chimique de symbole Fe.)
- Numéro atomique : 26
- Masse atomique : 55,847
- Température de fusion : 1 535 °C
- Masse volumique : 7,87 g/cm3
1. Chimie
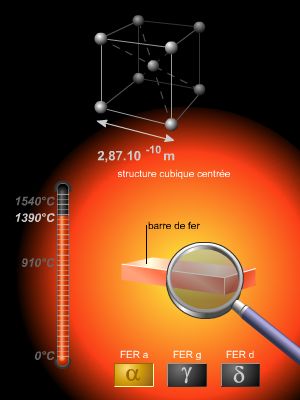
Le fer existe sous deux formes cristallines : fer α (ou ferrite), cubique centré, stable au-dessous de 910 °C, et ferro-magnétique jusqu'à 768 °C ; fer γ, cubique à faces centrées, stable de 910 à 1 390 °C. Le fer est ductile, malléable à froid et devient plastique à chaud.
Le fer peut s'unir directement à la plupart des non-métaux. Il brûle au rouge blanc dans l'oxygène (en donnant de l'oxyde magnétique Fe3O4), et dans le chlore, s'unit à chaud au soufre, décompose la vapeur d'eau au rouge, en donnant de l'hydrogène, et se dissout dans les acides dilués. À l'air humide, sa corrosion est très importante. On peut le protéger par revêtement (peinture, vernis, etc.), par protection cathodique ou par l'action d'inhibiteurs de corrosion (minium, chromates), qui le passivent. Le fer est divalent dans les composés ferreux, trivalent dans les composés ferriques. L'oxyde ferreux FeO, noir, est obtenu par réduction de l'oxyde ferrique à haute température. L'oxyde ferrique Fe2O3, ou sesquioxyde, est très répandu dans la nature ; la rouille en est un hydrate. L'oxyde magnétique Fe3O4, ou oxyde salin, constitue la pierre d'aimant naturelle. Le chlorure ferreux FeCl2 cristallise, hydraté, en prismes d'un vert bleuâtre. Le chlorure ferrique FeCl3 est un solide rouge ; il coagule le sang, d'où son emploi en médecine. Le sulfure FeS sert à préparer l'hydrogène sulfuré.
2. Métallurgie
2.1. Histoire de la métallurgie
Le fer était jadis extrait directement du minerai par réduction avec le carbone, surtout au moyen de charbon de bois (→ âge du fer). À partir du xiiie s., la métallurgie du fer se confond avec celle de la fonte et de l'acier, dont le développement est dû à l'utilisation de souffleries actionnées hydrauliquement et à la construction des premiers hauts-fourneaux. Le fer est alors obtenu par affinage, à l'état pâteux, de loupes soudées au four à bas foyer, ou four d'affinerie. Le procédé du puddlage permet d'obtenir des fers purs durant tout le xixe s. Il sera pratiquement abandonné devant l'apparition des procédés modernes d'élaboration de l'acier. (→ sidérurgie.)
2.2. Les minerais de fer
Les minerais les plus répandus sont les carbonates (sidérose ou fer spathique) et les oxydes, hydratés ou non (hématite brune 2Fe2O3, 3H2O ou minette phosphoreuse, hématites rouges Fe2O3 constituant le fer oligiste et le fer spéculaire ou micacée, surtout abondant en Russie et aux États-Unis).
2.3. Techniques et utilisations du fer
Parmi les fers industriels, on distingue : le fer coulé, obtenu par les procédés classiques d'élaboration de l'acier (fours Martin, Thomas, électrique), le fer électrolytique, préparé par électrolyse de chlorure ferreux avec anode soluble en acier ou en fonte, et le fer réduit, obtenu par réduction d'oxydes dans un milieu gazeux réducteur. Le fer carbonyle est un fer très pur obtenu par décomposition d'un complexe carbonylé. Le fer est utilisé en majeure partie sous forme d'aciers ou de fontes. À l'état brut de forgeage ou de laminage, le fer pur industriel a une résistance à la traction de 300 MPa, une limite d'élasticité de 200 MPa et un allongement à la rupture d'environ 25 %. Bonnes à froid, ses propriétés de plasticité sont parfois altérées à chaud, et le métal, dit rouverin, présente une fragilité qui gêne son forgeage. Cette fragilité, due à la présence de soufre et aussi d'oxygène, est supprimée par addition de manganèse. Lorsque le fer est suffisamment pur, sa résistance à la corrosion atmosphérique est bonne. Les fers sont employés à la confection de tôles, de feuillards, de boulons, de fils, de tubes, etc. Leurs propriétés magnétiques (principalement faible champ coercitif) les font utiliser, à l'état recuit, dans des appareillages électromagnétiques (pièces polaires d'électroaimants, tôles de machines électriques, noyaux de relais, etc.). Le fer pur s'emploie pour l'élaboration d'aciers fins, d'aciers ordinaires ou spéciaux, comme matière première de la fusion au creuset. La poudre de fer, réduit ou électrolytique, est utilisée pour fabriquer des pièces poreuses frittées ou pour constituer des enrobages d'électrodes de soudage et d'oxycoupage. Les pièces à base de fer fritté sont utilisées dans plusieurs branches d'activité industrielle (construction automobile, fabrication de matériel électrodomestique et de produits magnétiques).
2.4. Le diagramme fer-carbone
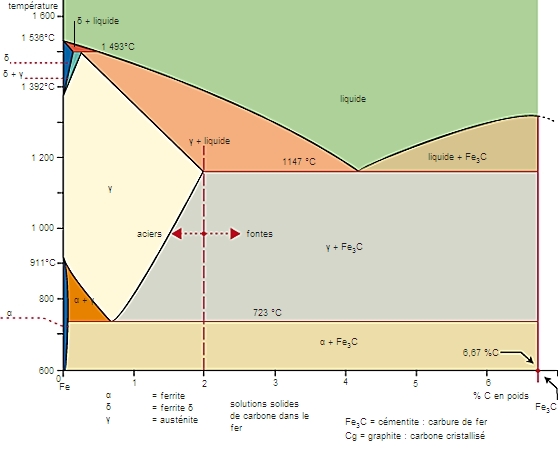
Le diagramme fer-carbone est une représentation des équilibres entre les phases physico-chimiques composant les alliages de fer et de carbone (aciers et fontes) en fonction de la température, à la pression atmosphérique.
Les alliages FeC contenant à l'équilibre moins de 2 % de carbone sont appelés aciers ; au-delà de 2 % de carbone, ce sont les fontes. Si le carbure Fe3C (cémentite) est peu stable, le graphite apparaît dans la structure (fontes grises). Ces diagrammes d'équilibre sont déformés lorsque les vitesses de chauffage ou de refroidissement augmentent : on a alors recours aux courbes de transformation au chauffage ou au refroidissement (courbes T.R.C.).
2.5. Production de fer dans le dans le monde
Base de la sidérurgie, l'extraction du minerai de fer est liée à l'évolution de cette branche. La production mondiale de minerai de fer est de l'ordre de 1 600 millions de tonnes. Une quarantaine d'États en extraient, mais un petit nombre d'entre eux (le Brésil, l'Australie, la Chine, l'Inde, les États-Unis, la Russie, l'Ukraine et le Canada) assurent environ 75 % du total mondial. La Suède est le seul producteur notable de l'Union européenne. La production française, autrefois importante, a totalement disparu. Le commerce mondial concerne la moitié de la production. Il est dominé, à l'exportation par le Brésil et l'Australie, qui représentent chacun environ 30 % du total des exportations et à l'importation par la Chine qui avec 45 % du total, se situe loin devant l'Union européenne et le Japon, qui pèsent respectivement 22 et 16 % du volume total. Des tensions sont apparues sur le marché mondial du minerai de fer, dues à plusieurs facteurs : accroissement de la demande chinoise, évolution du coût du fret maritime et plus récemment, baisse des prix en raison de la crise.
3. Architecture


Le fer a été employé forgé, en armature par les Grecs, en chaînage depuis le Moyen Âge. V. Louis l'a utilisé pour constituer la charpente du Théâtre-Français (1786). Par la suite, on a plutôt fait appel à la fonte moulée jusqu'au milieu du xixe s., moment où le laminage a permis d'obtenir des profilés et, par là, de réaliser des ossatures entièrement en fer riveté. Le « siècle du fer », qui, pour une bonne part, a correspondu à un emploi mixte, fer et fonte, pour des serres, des marchés (Baltard), des bibliothèques (Labrouste), des halls de gares (Hittorff) ou des ponts, a culminé avec la tour Eiffel et la galerie des Machines (Paris, 1889), à la veille du triomphe de l'acier.
4. Biochimie
Les animaux supérieurs et les végétaux contiennent environ 5 cg de fer par kilogramme de poids. Chez l'homme, le fer joue un rôle capital dans l'érythropoïèse comme constituant de l'hémoglobine et dans les phénomènes respiratoires de la cellule comme constituant des systèmes transporteurs d'électrons dans les mitochondries. Le taux normal de fer circulant varie de 0,80 à 1,70 mg par litre.
En pharmacie, le fer est surtout utilisé à l'état de sels organiques ferreux (fumarate, gluconate, oxalate) par voie buccale dans le traitement des anémies hypochromes.
Pour en savoir plus, voir l'article fer [médecine].