solvant
(latin solvere, dissoudre)

Liquide possédant la propriété de diluer ou d’extraire d’autres substances sans provoquer de modification chimique de ces substances et sans se modifier lui-même. (En peinture, les solvants les plus employés sont l'essence de térébenthine, le white-spirit, le trichloréthylène, l'acétone.)
CHIMIE
Généralités
Les solvants sont des composés chimiques très courants dans la vie quotidienne. Il en existe environ un millier, dont une centaine d’usage courant, principalement dans l’industrie des peintures et des revêtements.
De manière générale, le solvant est utilisé en plus grande quantité que le composé chimique à dissoudre. Si l’on considère le cas simple d’une petite quantité de sel de cuisine plongée dans un verre d’eau, on s’aperçoit que le sel se décompose en ions sodium et chlorures dispersés dans l’eau : l’eau est alors définit comme le solvant, le sel comme le soluté, et le mélange des deux constitue la solution. Le solvant et le soluté réagissent jusqu’à atteindre un état d’équilibre.
Du fait de sa très grande capacité diélectrique, l'eau est, de tous les liquides connus, le plus proche d'un solvant universel et inerte.
Classification des solvants
Les principaux types de solvants
On distingue deux types principaux de solvants :
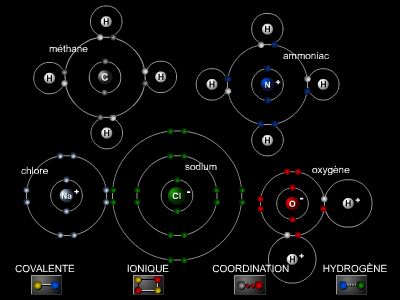
les solvants protiques, contenant des hydrogènes mobiles, c'est-à-dire ayant tendance à gagner ou à perdre des protons H+. Ces solvants possèdent un ou plusieurs atomes d’hydrogène susceptibles de former des liaisons hydrogènes, par exemple, l’eau, les alcools, etc. ;
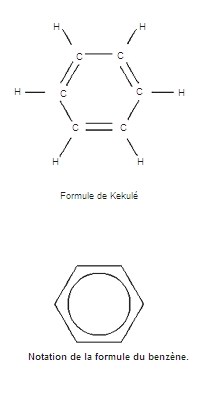
les solvants aprotiques, n’ayant aucune tendance à gagner ou à perdre des protons ; ces solvants se subdivisent en deux catégories : les solvants aprotiques polaires qui possèdent un moment dipolaire non nul (les différents groupements de la même molécule échangent des charges entre eux), tels que l’acétonitrile (CH3CN) ou le diméthylsulfoxyde (DMSO, (CH3)2SO), etc. ; et les solvants aprotique apolaires qui possèdent un moment dipolaire permanent nul, comme les hydrocarbures (alcanes, alcènes, benzène, etc.)
Les grandes familles de solvants industriels
Les solvants industriels sont des hydrocarbures, c’est-à-dire des molécules formées d’atomes de carbone et d’hydrogène. On en distingue 8 groupes principaux, auxquels s’ajoutent quelques solvants particuliers :
•hydrocarbures aromatiques (benzène, toluène, xylènes, etc.) ;
•solvants pétroliers (non aromatiques : alcanes, alcènes, etc.) ;
•alcools (méthanol, éthanol, glycols, etc.) ;
•cétones (acétone, etc.) ;
•esters (acétates, agrosolvants, etc.) ;
•éthers (éther éthylique, tétrahydrofurane, etc.) ;
•éthers de glycol (éthers de l’éthylène glycol et du propylène glycol) ;
•hydrocarbures halogénés (chlorés, bromés ou fluorés) ;
•solvants particuliers (amines, amides, terpènes, etc.).
Utilisations et gestion des solvants
Selon leurs propriétés, les solvants peuvent servir de dégraissants (nettoyage des métaux, des textiles...), d’adjuvants et diluants (peintures, vernis, encres, colles, pesticides), de décapants (élimination des peintures, vernis, colles...), ou encore de purifiants (parfums, médicaments).
Après utilisation, les solvants peuvent être recyclés et parfois réutilisés dans le même procédé à de nombreuses reprises ; mais lorsque ce n’est pas le cas, ils doivent être soigneusement récupérés puis incinérés car ils sont très polluants, voire toxiques. Ainsi un solvant organique ne doit jamais être jeté dans un évier ou dans tout réseau d'évacuation des eaux.
Risque et toxicité des solvants
La plupart des solvants sont toxiques, avec un degré de toxicité très variable d’un solvant à un autre. Ils peuvent pénétrer dans l’organisme de trois façons différentes :
•par voie respiratoire, en raison de leur grande volatilité ;
•par voie cutanée (contact avec la peau) ;
•par voie digestive (absorption accidentelle).
Par conséquent, il est impératif de respecter toutes les consignes de sécurité lors de l’utilisation des solvants (toujours bien vérifier l’étiquetage), de leur manipulation, de leur stockage et de leur gestion après utilisation (recyclage ou incinération).