oxydoréduction

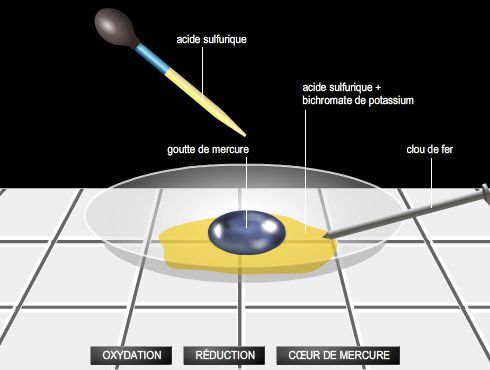
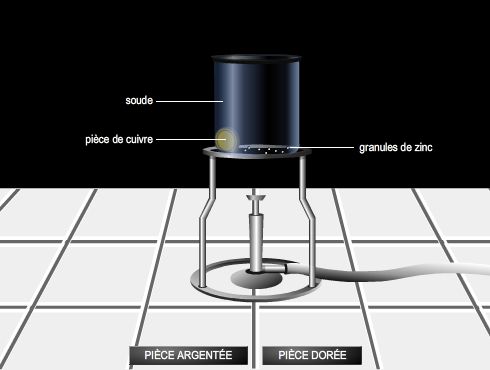
Action chimique d'un corps oxydant sur un corps réducteur, avec à la fois une oxydation du réducteur et une réduction de l'oxydant.
Le phénomène d’oxydoréduction
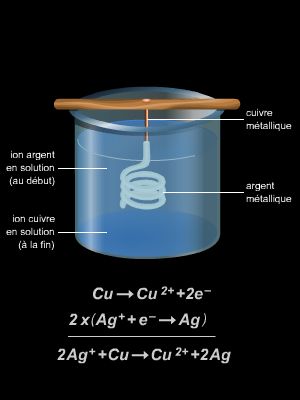
L'importance de l'oxydoréduction, phénomène chimique ou électrochimique, est considérable tant par ses effets spontanés, bénéfiques (photosynthèse) ou néfastes (corrosion), que par ses applications multiples dans la vie quotidienne (piles, accumulateurs…) ou dans l'industrie chimique et électrochimique.
Depuis la découverte du feu, l'homme a su mettre à profit la combustion du bois pour obtenir de l'énergie thermique ainsi que la réduction des minerais lors de la préparation du fer, sans connaître les réactions chimiques mises en jeu. Ce n'est qu'à la fin du xviiie s. que la combustion est apparue comme une oxydation, c'est-à-dire une combinaison avec un élément de l'air, l'oxygène.
Au sens strict, l'oxydation est la fixation d'oxygène sur un corps, la réduction, le phénomène inverse ; ces deux phénomènes sont d'ailleurs généralement couplés. Ainsi, dans la réaction 2CuO + C → 2Cu + CO2, on assiste simultanément à l'oxydation du carbone et à la réduction de l'oxyde de cuivre ; ce dernier est l'oxydant (noté Ox), le carbone étant le réducteur (Red) ; la réaction est une oxydoréduction.
Plusieurs éléments, tels les halogènes, le soufre, etc., se comportent dans certaines de leurs réactions comme l'oxygène ; on convient de dire que, par exemple, la combustion du sodium dans le chlore (qui donne Na+Cl−) est une oxydation du métal, au même titre que sa combustion dans l'oxygène. La transformation du sodium en ions Na+ est une oxydation du sodium ; elle est obtenue par enlèvement d'électrons. Corrélativement, la réduction du chlore en ions chlorure Cl− résulte de la fixation d'électrons. Au cœur de l'oxydoréduction se trouve donc l'électron, particule très mobile et omniprésente dans toutes les formes de la matière.
Le couple redox
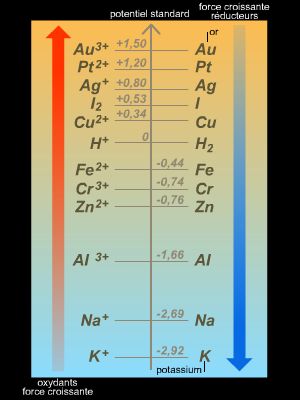
Le sens du terme oxydoréduction, contraction de « oxydation » et de « réduction », a évolué au cours du temps : ainsi pour Antoine Laurent de Lavoisier, le terme oxydation signifiait fixation d'oxygène, et le mot réduction désignait la perte d'oxygène, par exemple :
S + O2 → SO2 (oxydation),
2HgO → 2Hg + O2 (réduction).
Cependant, on constate que dans de nombreux cas l'expression ne porte que sur l'évolution chimique d'un seul des deux constituants de la réaction ; ainsi en est-il de la réduction de l'oxyde de cuivre II par le dihydrogène :
CuO + H2 → Cu + H2O,
où une ambiguïté apparaît, dans les termes, car on néglige ici le dihydrogène qui, lui, subit une oxydation. En fait, et d'une manière générale, toute réaction de réduction est accompagnée d'une réaction d'oxydation, et réciproquement. Seule l'électrochimie permet de les séparer dans certaines conditions.
Mais il apparaît que la notion d'oxydation peut s'appliquer aussi à la réaction :
Li + 1/2 Cl2 → LiCl,
comparable à la réaction :
2Li + 1/2 O2 → Li2O ;
dans la première, le lithium (Li) est transformé en Li+ par la perte d'un électron (e−), récupéré par le dichlore ; dans la seconde, deux électrons perdus par deux atomes Li sont fixés par l'oxygène pour former l'ion O2− ; dans les deux cas, on dit qu'il s'agit d'une oxydation du lithium due à une perte d'électrons, accompagnée d'une réduction du chlore ou de l'oxygène due, elle, à un gain d'électrons.
Une autre façon d'exprimer le phénomène est de dire que le lithium est un réducteur, c'est-à-dire une espèce chimique pouvant fournir un électron, et que le dichlore et le dioxygène sont des oxydants susceptibles de capter un ou des électrons. Li et Li+ forment ce qu'on appelle un couple redox (abréviation de réduction-oxydation), noté Li+/Li (soit Ox/Red).
On l'écrit : Li ⇌ Li+ + e−,
Li étant le réducteur, et Li+ l'oxydant. La double flèche indique que, dans certaines conditions, on sait réaliser :
Li+ + e− → Li (ce qui est du domaine de l'électrochimie).
D'une manière générale, on peut écrire les demi-réactions d’oxydoréduction suivantes :
Red1 ⇌ Ox1 + n1e−
et :
Ox2 + n2e− ⇌ Red2.
Les réactions d'oxydoréduction
Les équations chimiques correspondant aux réactions d'oxydoréduction peuvent être décrites en utilisant les couples redox, sous réserve de satisfaire à certaines conditions thermodynamiques, et de telle sorte que les électrons fournis par le réducteur 1 (Red1) soient récupérés par l'oxydant 2 (Ox2). Ainsi, l'équation chimique générale d'oxydoréduction :
n2Red1 + n1Ox2 ⇌ n2Ox1 + n1Red2
fait-elle intervenir les deux couples redox suivants :
(Red1 ⇌ Ox1 + n1e−) . n2
et
(Ox2 + n2e− ⇌ Red2) . n1,
dont l'addition permet de retrouver l'équation précédente. Cette façon de procéder est aisée quand interviennent des réactions ioniques qui permettent de connaître n1 et n2 sans difficulté. Par exemple, l'action d'un acide en milieu aqueux sur le zinc fait intervenir deux couples redox bien connus :
Zn → Zn2+ + 2e−,
(H3O+ + e− → 1/2 H2 + H2O) . 2.
Dans les conditions thermodynamiques convenables, les deux réactions se produisent dans le sens 1, donnant la réaction globale :
Zn + 2 H3O+ → Zn2+ + H2 + 2 H2O.
Le degré d'oxydation
Il existe aussi des couples redox tels que :
Fe2+ ⇌ Fe3+ + e−, où l'on voit aisément que Fe3+ est plus oxydé que Fe2+, puisqu'il résulte de la perte d'un électron par ce dernier.
Mais, avec des ions comme Cl−, ClO−,ClO3−, ClO4−, il est difficile de distinguer les éléments les plus oxydés.
Les chimistes ont été ainsi amenés à attribuer un degré d'oxydation, ou nombre d'oxydation (NO), positif ou négatif, aux différents éléments et à leurs ions lorsqu'ils sont engagés dans divers composés ; pour le distinguer de la charge des ions, on le représente par un chiffre romain, précédé du signe + ou −. Pour déterminer ce nombre formel, on utilise les règles suivantes :
– tout élément à l'état de corps pur a un nombre d'oxydation 0 (c'est le cas de O dans O2, de H dans H2, de Fe dans le fer métal) ;
– dans une espèce chimique non chargée, la somme algébrique des NO des éléments constitutifs est égale à 0 (c'est le cas pour H et O dans H2O, pour Na et Cl dans NaCl);
– dans une espèce ionique, la somme algébrique des NO des éléments constitutifs est égale à la charge de l'ion. Ainsi, dans ClO−, la somme algébrique des NO de Cl et de O est −1 ; il en est de même dans ClO4−.
Partant de ces règles, le NO d'un élément dans une molécule ou dans un ion est, en valeur absolue, égal au nombre d'électrons qu'il aurait fixés, si c'est l'élément le plus électronégatif, ou qu'il aurait perdus, si c'est l'élément le moins électronégatif, si on considérait que toutes ses liaisons sont ioniques. On lui attribue le signe − s'il a fixé les électrons, le signe + s'il les a perdus. Plus le nombre d'oxydation est élevé (en valeur algébrique), plus l'élément est oxydé ; plus il est bas, plus l'élément est réduit. Par exemple :
H+, Li+, Na+, … NO = + I ;
Al3+, Te3+, Cr3+, … NO = + III ;
H−, F−, Cl−, … NO = − I ;
O2−, S2−, … NO = − II.
Dans le cas des ions simples, le NO est donc égal à la charge de l'ion.
L'équation de Nernst
Si le système redox :
Ox + ne− ⇌ Red,
obéit aux lois de la thermodynamique (les phénomènes cinétiques, très importants dans ce domaine, risquent de masquer le comportement thermodynamique), une expression relativement simple, l'équation de Nernst, lie le potentiel ET de ce système (où la concentration de l'oxydant et celle du réducteur ne sont pas égales à 1 mol . −1) au potentiel standard E0T (où la concentration de l'oxydant et celle du réducteur sont égales à 1 mol . l−1) et au nombre n d'électrons échangés à une température donnée T :
ET = E0T + (RT/nΦ) × log [Ox]/[Red],
où E0T, potentiel standard du système (sous une pression de 1 bar), est une constante, consignée dans des tables, qui en caractérise la nature chimique à une température donnée T exprimée en degrés Kelvin (si T = 298 K, E0 est le potentiel standard normal),
R la constante des gaz parfaits (8,31 J . K−1 . mol−1),
Φ la constante de Faraday (96 500 C . mol−1),
[Ox] et [Red] correspondant aux activités de Ox et de Red que l'on assimile ici aux concentrations [Ox] et [Red] en mol . l−1.
À 298 K (25 °C), cette expression s'écrit souvent sous la forme :
ET = E0T + (0,06/n) × log [Ox]/[Red],
où les potentiels sont exprimés en volts (V).
Prévision des réactions
En solution, lorsque l’on a en présence deux couples rédox Ox1/Red1 et Ox2/Red2, de potentiels standards respectifs E01 et E02, et que E01 > E02, c'est l'oxydant 1, appartenant au couple redox 1 – dont le potentiel est le plus élevé – qui oxyde le réducteur 2 appartenant au couple redox 2 – dont le potentiel est le moins élevé.
Applications
Les réactions d'oxydoréduction interviennent dans nombre de processus naturels ou artificiels, tant dans des réactions en solution qu'en phase solide. Tel est le cas de la plupart des réactions métallurgiques permettant l'élaboration des métaux à partir de leurs minerais, comme celle citée en introduction. Ces réactions, dont certaines étaient connues depuis l'Antiquité, mettaient déjà en pratique des principes thermodynamiques qui ne furent élucidés que bien plus tard. Cela explique que, au cours de l'histoire, les métaux ont été élaborés dans l'ordre de difficulté croissante de réduction, depuis le cuivre, vers 4000 avant J.-C., jusqu'à l'aluminium, en 1825. Les phénomènes d'oxydoréduction ont également un rôle crucial en biologie. Ils permettent notamment la respiration cellulaire des organismes vivants.










