alcène
Hydrocarbure dérivant des alcanes, contenant une double liaison C=C et de formule générale CnH2n.
Produits au cours du raffinage du pétrole brut, les alcènes sont des composés très utilisés dans l’industrie chimique, notamment pour la production des polymères.
1. Nomenclature et propriétés physiques des alcènes
Les alcènes, de formule générale CnH2n (où n est le nombre d’atomes de carbone dans la molécule), comportent une ou plusieurs doubles liaisons. Leur nomenclature dérive de celle des alcanes, la terminaison en -ane étant remplacée par une terminaison en -ène (éthène, propène, etc. → chimie organique, hydrocarbure).
Comme ils renferment une double liaison, ils présentent, à partir du butène (C4H8), des isoméries de position et de géométrie (existence de deux isomères correspondant à des dispositions relatives différentes des groupes alkyles sur la double liaison).
Ainsi, pour le but-2-ène, on a les deux isomères suivants : le cis-but-2-ène (les substituants prioritaires sont du même côté du plan formé par la double liaison) et le trans-but-2-ène (substituants prioritaires de part et d’autre de la double liaison) :
 et
et

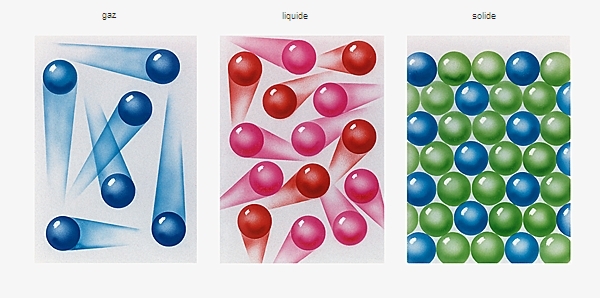
Pour un même nombre d’atomes de carbones, les alcènes ont des points d’ébullition légèrement inférieurs de ceux des alcanes. Aussi, à l’instar des alcanes, les quatre premiers termes des alcènes (jusqu'à C4H8) sont gazeux dans les conditions de température et de pression ordinaires ; les termes suivants sont liquides jusqu’à C18H36, et au-delà, ils sont solides.
Par ailleurs, les alcènes sont insolubles dans l’eau, mais solubles dans les autres hydrocarbures.
2. Réactivité des alcènes
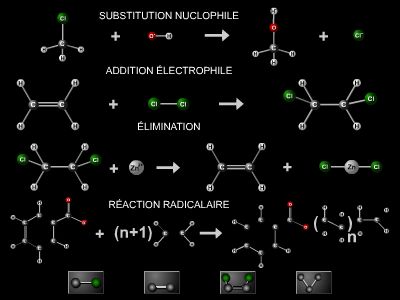
Les alcènes sont caractérisés par une plus grande réactivité chimique que les alcanes. Ce sont surtout des réactions d’addition électrophile qui se produisent sur la double liaison avec l’action de divers réactifs dits électrophiles (H2O, HCl, HOCl, halogènes, etc.) : ces derniers sont générateurs d’espèces présentant une déficience électronique, en général des cations.
Ainsi, l’éthylène (ou éthène) fixe le brome en plusieurs étapes : la double liaison est d’abord attaquée par le cation Br+ (issu de la molécule Br2) avec formation d’un carbocation bromé (BrCH2–CH2+) qui fixe ensuite l’anion Br− :
Br2 → Br+ + Br−
Br+ + CH2=CH2 → BrCH2–CH2+
BrCH2–CH2+ + Br− → BrCH2–CH2Br
Avec les alcènes non symétriques (RCH=CHR′ et RR′C=CR′′R′′′), la réaction est stéréospécifique, et on obtient deux produits différents en quantités inégales : la réaction présente une régiosélectivité (→ stéréochimie).
En outre, les deux fragments du réactif électrophile (cation, puis anion) se fixent de part et d’autre du plan de la double liaison (trans-addition).
Ainsi, dans l’addition de HCl sur un alcène non symétrique, le cation H+ se fixe préférentiellement sur l’atome de carbone portant le plus petit nombre de substituants alkyles R (règle de Markovnikov) :
RCH=CH2 + HCl → RCHCl–CH3
Cette règle n’est cependant pas absolue ; en présence notamment de peroxydes, HBr se fixe sur un alcène non symétrique, en sens inverse de celui qui correspond à la règle de Markovnikov : c’est l’effet Kharasch (mécanisme radicalaire) ; le radical Br• se fixe sur l’atome de carbone portant le moins de substituants alkyles :
RCH=CH2 + HBr → RCH2–CH2Br
Les alcènes, en présence de catalyseurs, fixent également l’hydrogène pour donner des alcanes :
RCH=CHR′ + H2 → RCH2–CH2R′
L’addition de monoxyde de carbone (CO) en présence d’hydrogène et de catalyseurs conduit aux aldéhydes (réaction oxo).
L’oxydation des alcènes par divers réactifs chimiques correspond également à une addition sur la double liaison : elle peut se faire sans qu’il y ait de coupure de la chaîne carbonée. Par exemple, avec le peroxyde d’hydrogène (H2O2), il se forme d’abord un époxyde, qui s’hydrolyse ensuite en diol (glycol). La fixation des deux groupes OH (→ alcool) se réalise de part et d’autre du plan de la double liaison : c’est une trans-addition.
En revanche, un alcène à froid, en milieu basique, avec du permanganate de potassium (KMnO4) dilué, conduit à un diol ; lors de cette réaction, la fixation des deux groupes OH s’effectue sur le même côté du plan de la double liaison, sans coupure de la chaîne carbonée : il s’agit d’une cis-addition.
Dans des conditions plus rudes, il peut cependant y avoir une coupure de la chaîne carbonée. Ainsi, KMnO4 en solution concentrée à chaud brise les alcènes au niveau de la double liaison avec formation de deux fragments carbonylés (cétones et/ou acides).
Cette coupure brutale peut également être provoquée par l’ozone (O3) ; ce gaz, si important pour la protection contre le rayonnement solaire, se fixe facilement sur la double liaison d’un alcène pour former un ozonide instable dont l’hydrolyse fournit deux fragments carbonylés (aldéhydes et/ou cétones). Cette réaction était utilisée autrefois dans les laboratoires pour préciser la position d’une double liaison dans une chaîne carbonée, car les produits obtenus sont beaucoup plus faciles à analyser.
Les alcènes réagissent également par substitution radicalaire en α de la double liaison avec les halogènes sous irradiation ou à haute température. Ici, l’atome de brome se fixe sur l’atome de carbone voisin de la double liaison :
RCH2–CH=CH2 + Br2 → RCHBr–CH=CH2 + HBr
Cette facilité des alcènes à réagir ainsi a aussi des désavantages, car ils s’oxydent facilement à l’air : l’oxygène se fixe sur l’atome de carbone voisin de la double liaison avec formation d’un hydroperoxyde instable, qui se transforme ensuite (autoxydation, responsable du vieillissement du caoutchouc, du rancissement des graisses, etc.).
Cependant, du fait des multiples possibilités de réactions d’addition des alcènes, on réalise des réactions de polymérisation, en présence de catalyseurs, pour la préparation industrielle du polyéthylène et du polypropylène.
3. Les alcènes à l'état naturel
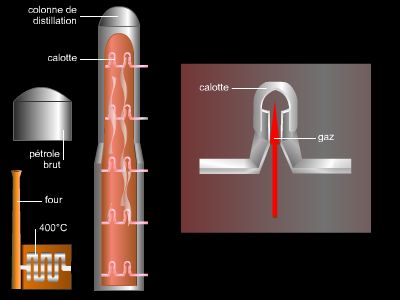
Contrairement aux alcanes, les alcènes sont extrêmement rares dans la nature, les pétroles ne contenant pas ce type d’hydrocarbures. Ils sont formés en quantité industrielle par vapocraquage au cours du raffinage du pétrole brut.
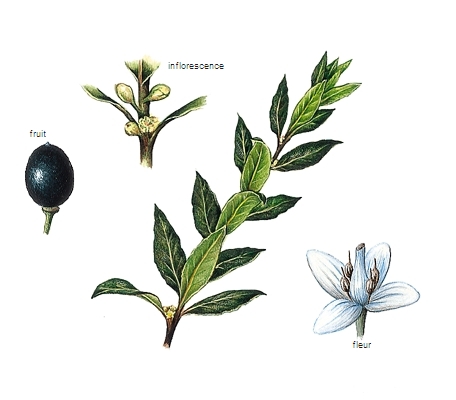
En revanche, on trouve à l’état naturel des polyènes qui renferment plusieurs doubles liaisons, comme l’ocimène du basilic ou le myrcène du laurier.
4. Préparations des alcènes
Pour préparer des alcènes, autrement dit former des doubles liaisons C=C, on peut soit réaliser des réactions d’élimination à partir de composés saturés, soit réaliser des réactions d’addition à partir d’alcynes (ouvrir une triple liaison).
Pour en savoir plus, voir l'article synthèse [chimie]
4.1. Par réactions d'élimination
Parmi les réactions classiques d’élimination, on trouve :
• la déshydratation d’un alcool (en présence de catalyseurs acides), par exemple :
CH3–CHOH–CH3 → CH3–CH=CH2 + H2O
• la déshydrohalogénation d’un dérivé monohalogéné (en présence de réactifs basiques), par exemple :
CH3–CH2Br + OH– → H2C=CH2 + H2O + Br–
4.2. Par réactions d'addition
La préparation classique d’un alcène à partir d’une réaction d’addition consiste en la semi-hydrogénation d’une triple liaison en présence de d’un catalyseur peu actif pour ne pas aboutir à un alcane. Par exemple :
CH3–C≡CH + H2 → CH3–CH=CH2
5. Utilisations des alcènes

Les alcènes, et tout particulièrement les premiers termes (éthylènes, propènes et butènes) sont des composés incontournables dans l’industrie chimique. Ce sont les composés de base de la production de polymères (matières plastiques, etc.) et de nombreuses synthèses (aldéhydes, alcools, acides, etc.) dont les produits finis sont d’usage courant : cosmétiques, peintures, solvants, etc.
Pour en savoir plus, voir l'article chimie.