alcane
(de alcool)
Hydrocarbure saturé à chaîne ouverte, de formule générale CnH2n+2. (Synonyme : paraffine.)
Issus des gisements de gaz naturels et de pétrole, les alcanes sont d’une importance capitale comme source d’énergie et comme matière première dans l’industrie chimique.
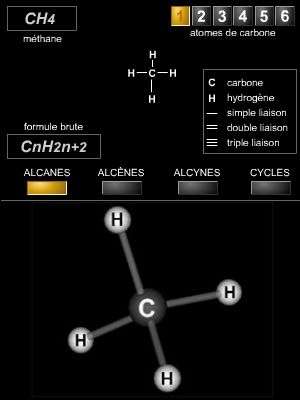
Dénommés également paraffines, les alcanes sont des hydrocarbures acycliques saturés de formule générale CnH2n+2. On peut les représenter symboliquement par la notation RH, où R correspond à un groupe alkyle (CnH2n+1). Ils ne comportent que des liaisons carbone-carbone simples. Cependant, selon la nature et la structure de leurs chaînes carbonées, on distinguera les alcanes à chaîne carbonée linéaire et les alcanes ramifiés (→ carbone, chimie organique).
1. Nomenclature et propriétés physiques des alcanes
1.1. Les alcanes linéaires
Selon la nomenclature officielle de l’IUPAC (International Union of Pure and Applied Chemistry), le nom d’un alcane linéaire est donné par la chaîne carbonée la plus longue (chaîne principale) : méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10), pentane (C5H12), etc.

Leurs points d’ébullition ou de fusion augmentent régulièrement avec la masse moléculaire. Ainsi les alcanes légers, du méthane au butane, sont des gaz dans les conditions de température et de pression ordinaires. Puis, à partir du pentane jusqu’à l’hydrocarbure en C16, ce sont des liquides, avec un point d’ébullition de plus en plus élevé, et, à partir de C17, des solides dont le point de fusion ne dépasse pas 100 °C .
1.2. Les alcanes ramifiés
Les chaînes latérales (groupes alkyles) sont désignées par des préfixes accolés au nom de la chaîne carbonée linéaire la plus longue et précédés des indices de position correspondants. Par exemple, le 2-méthylbutane a la formule semi-développée suivante :
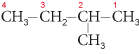
La ramification de la chaîne abaisse les températures de fusion et d’ébullition. Ces alcanes présentent l’isomérie de position à partir du terme en C4 (dans l’exemple précédent, la ramification se trouve sur le carbone d’indice 2, soit le 2-méthylbutane) et l’isomérie optique (apparition du pouvoir rotatoire) à partir de C7.
Pour en savoir plus, voir les articles alcène, alcyne.
2. Réactivité des alcanes
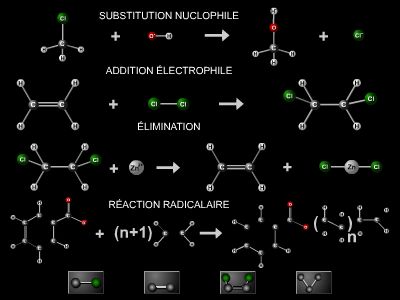
Les alcanes sont caractérisés par une grande inertie chimique vis-à-vis de la plupart des réactifs. Ils ne donnent pas de réactions d’addition, mais réagissent par substitution radicalaire avec des réactifs générateurs de radicaux, tels les halogènes : le chlore et le brome (sous irradiation ou à haute température), le fluor (réaction violente). Ainsi, avec le méthane et le chlore, il se forme successivement : CH3Cl, CH2Cl2, CHCl3 puis CCl4.
Ces réactions de substitution ne sont pas sélectives, et n’importe quel hydrogène d’un alcane peut être substitué. La substitution des hydrocarbures ramifiés est d’autant plus facile que l’atome de carbone intéressé porte davantage de groupes alkyles.
La nitration directe, formation directe de dérivés R–NO2, ne s’effectue qu’en phase vapeur et avec quelques termes seulement. La sulfonation, formation directe de dérivés R–SO3H, est très difficile.

Cependant, ce sont des combustibles d’une grande importance pratique, leur réaction avec l’oxygène provoquant un important dégagement de chaleur (→ combustion) :
2 CnH2n+2 + (3n + 1) O2 → 2n CO2 + (2n + 2) H2O
3. Les alcanes à l'état naturel
Les alcanes sont très répandus dans la nature. On les trouve sous forme de gisements de gaz naturel (composé principalement de méthane) et de pétroles (il existe une très grande variété de pétroles qui diffèrent selon les mélanges d’hydrocarbures qu’ils contiennent).
4. Préparations des alcanes
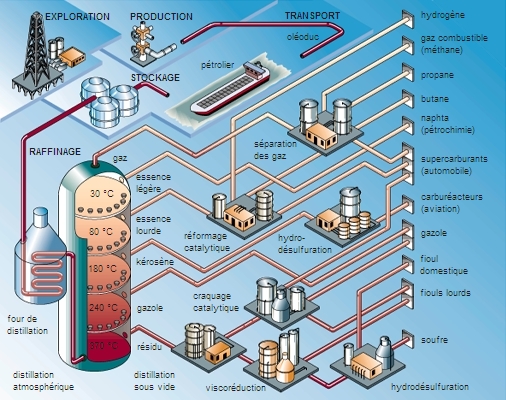
On peut obtenir les premiers termes de la série des alcanes (du méthane, CH4, à l’hexane, C6H14) à l’état pur à partir du pétrole brut. Mais pour les termes suivants, dont les points d’ébullition sont assez proches, il est nécessaire d’utiliser des méthodes de préparation plus spécifiques en laboratoire. Toutefois, du fait de leur faible réactivité, donc de leur faible intérêt comme réactifs ou intermédiaires de synthèse, les chimistes ne préparent que très rarement des alcanes à l’état pur (→ synthèse [chimie]).
On peut néanmoins obtenir des alcanes lors des réactions suivantes (celles-ci étant généralement effectuées dans un tout autre but que celui de préparer spécifiquement des alcanes) :
• par réduction d’un halogénure d’alkyle RX par l’hydrogène, en présence d’un catalyseur tel que le palladium :
RX + H2 → RH + HX
• par hydrogénation des alcènes et des alcynes, en présence de catalyseurs tels que le nickel ou le platine, transformant ainsi les doubles et triples liaisons en liaisons simples.
• par décarboxylation des acides carboxyliques, généralement par chauffage en milieu basique.
5. Utilisations des alcanes

Le principal intérêt des alcanes est bien entendu leur utilisation à la fois comme sources d’énergie (énergies fossiles) et comme matières premières pour la fabrication de produits pétrochimiques (matières plastiques, détergents, etc.). Ils font donc partie de l’industrie chimique lourde.