pH
(p, potentiel, et H, hydrogène)

Mesure de l'état acido-basique d'une solution contenant des ions H+, définie par pH = − log10 [H+], où [H+] est la concentration de la solution en ions H+.
CHIMIE
Notion de pH
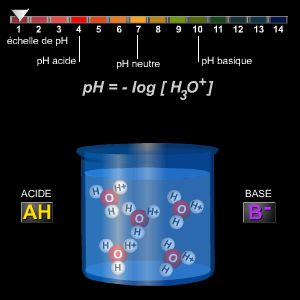
La définition acido-basique généralement admise demeure attachée au rôle privilégié du solvant protoné H2O et à celui du proton hydraté. On a donc introduit une grandeur mesurable expérimentalement et liée à la spécificité des réactions étudiées, le pH, qui est le cologarithme décimal de la concentration en ions hydronium (H3O+) exprimée en moles d'ions par litre de solution :
pH = − log [H3O+].
Dans l'eau, le pH varie de 0 (équivalent de [H3O+] = 1) à 14 (équivalent de [HO−] = 1), et, pour un acide, l'équilibre d'acidité conduit à :
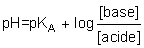
où [acide] et [base] sont les concentrations des formes acide et base conjuguées, exprimées elles aussi en mol . l−1.
Si [base] > [acide], alors pH > pKA ;
si au contraire [acide] > [base], alors pH < pKA.
La valeur de pH égale au pKA met une frontière nette dans la prédominance des formes du couple acide-base conjugué. Il est ainsi possible de préciser que l'équilibre est considéré comme totalement déplacé vers une forme (acide ou basique) lorsque cette forme est en concentration cent fois plus grande que celle de la forme conjuguée ; alors que la valeur
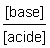 du rapport est comprise entre 10−2 et 102, le pH, lui, est compris entre pKA − 2 et pKA + 2. Pour toute valeur de pH inférieure à pKA − 2, l'acide est dominant ; pour toute valeur de pH supérieure à pKA + 2, la forme basique est prépondérante.
du rapport est comprise entre 10−2 et 102, le pH, lui, est compris entre pKA − 2 et pKA + 2. Pour toute valeur de pH inférieure à pKA − 2, l'acide est dominant ; pour toute valeur de pH supérieure à pKA + 2, la forme basique est prépondérante.
Grâce à l'informatique, le calcul du pH d'une solution est chose aisée. Il suffit de poser les équations de conservation des éléments (la masse de l'ensemble du système ne varie pas au cours d'une réaction chimique), la neutralité électrique du milieu, les constantes des équilibres KA, Ke, et de programmer.
Les indicateurs colorés d'acido-basicité
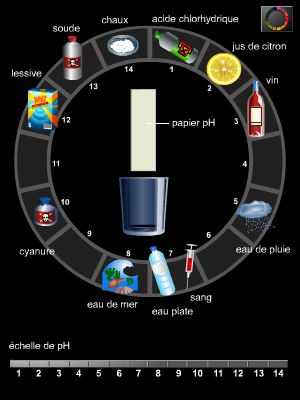
On peut suivre de diverses manières l'évolution du pH quand une base est versée dans une solution acide (ou réciproquement) : soit à l'œil nu, grâce aux indicateurs colorés d'acido-basicité, soit, plus en détail, par la mesure du pH avec un pH-mètre, ou par la mesure de la mobilité des ions au moyen d'un conductimètre.
Les indicateurs colorés révèlent la fonction chimique que l'on veut caractériser, car ils possèdent la fonction acide-base, avec la particularité que l'une ou l'autre, ou les deux espèces en lesquelles ils se transforment prennent des teintes différentes.
Le changement de teinte se produit pour la plage de pH qui encadre la valeur du pKA de l'indicateur coloré. Plus cette plage est restreinte, meilleur est l'indicateur. Pour chaque valeur de pH que l'on veut visualiser, il faut choisir un indicateur coloré dont le pKA a pour valeur celle de ce pH.
Ces colorants se trouvent parfois dans la nature et attestent la présence de réactions d'acido-basicité : campanules bleues qui pâlissent sous les pattes de fourmis (acide formique ou méthanoïque), hortensias bleus ou roses selon l'acidité du sol. Certaines substances naturelles, mélanges de plusieurs couples acide-base colorés, s'avèrent de vrais indicateurs universels par la succession colorée des tests acido-basiques auxquels elles donnent lieu : tel est le cas du jus de chou rouge (rouge dans la vinaigrette acide ; bleu dans l'eau de rinçage neutre ; jaune-vert dans l'eau de nettoyage, rendue basique par addition de détergent).
Solution tampon
Une solution tampon est une solution dont le pH ne varie que de manière négligeable si on l'acidifie ou si on la basifie ou si on la dilue. Le cas se présente lorsqu’à un acide faible (ou à une base faible) on ajoute une quantité de base (ou d'acide, dans l'autre cas) équivalente à la moitié de la quantité nécessaire pour les transformer en leur forme conjuguée. Pour le couple acide-base conjugué,
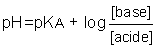
et, puisque [base] et [acide] restant en solution sont à des concentrations égales, on en déduit que pH = pKA.
Pour effectuer une réaction à pH déterminé, on utilise une solution tampon correspondant à ce pH, c'est-à-dire un acide faible (ou une base faible) dont le pKA est égal à la valeur du pH recherché ; pour obtenir ce tampon, on réalise un mélange équimolaire de l'acide (ou de la base) et de sa combinaison avec une base forte (ou un acide fort).
Un domaine où la réalisation de réactions chimiques à pH donné revêt une grande importance est celui de la biologie. En biologie cellulaire, les enzymes ne peuvent exister que dans une zone où le pH présente une faible variation : 6,8 pour l'amylase de la salive, de 1,6 à 1,8 pour la peptase de l'estomac, 9 pour celle du pancréas. Le pH sanguin doit être proche de 7,45 ; en dehors des limites 7 et 7,9, c'est la mort.
Grâce aux solutions tampons, notamment par le rôle de certains composés chimiques, et à leur pouvoir de régulation du pH, le corps humain maintient ces pH constants. Ainsi, ce sont les phosphates qui tamponnent le sérum sanguin.
Influence du pH sur la solubilité de composés peu solubles
Il existe des constituants qui ne peuvent rester en solution sous forme d'ions au-delà d'une certaine concentration. On définit pour ces constituants un produit de solubilité Ks.
Pour des carbonates de cations métalliques divalents M2+, par exemple, Ks = [CO32−] [M2+].
Tant que Ks n'est pas atteint, la solution est limpide ; quand Ks est atteint ou dépassé, un précipité apparaît et se développe.
Réciproquement, à partir d'un carbonate solide, si on diminue par voie chimique la concentration des ions CO32−, on solubilise le carbonate initialement solide ; cette voie chimique peut être l'acidité. Ainsi, CO2 est un gaz acide ; l'ion hydrogénocarbonate (HCO3−) est soluble, le carbonate de calcium (CaCO3) l'est peu.
L'ampholyte HCO3− peut apparaître en solution par la réaction :
CaCO3 + CO2 + H2O → 2 HCO3− + Ca2+.
La détérioration de certains monuments résulte de la dissolution du calcaire en hydrogénocarbonate par suite de l'augmentation de l'acidité : le dioxyde de carbone issu de la respiration humaine est responsable de la dégradation de la grotte de Lascaux ; le dioxyde de soufre, rejet industriel, a sérieusement endommagé les statues de l'Acropole. Des mesures ont dû être prises pour sauvegarder ces sites historiques ; elles vont de la réduction du nombre de visiteurs à leur fermeture au public.
Évolution de la notion d'acidité
Tout en conservant la place privilégiée du proton, atome d'hydrogène ayant perdu son seul électron, on peut transposer tout ce qui a été dit de l'eau aux solvants protiques :
Ke = [H3O+] [HO−] devient Ki = [NH4+] [NH2−] pour l'ammoniac, et Ki = [ROH2+] [RO−] pour un alcool ROH.
En passant de l'eau à un autre solvant protique, on peut différencier les bases plus fortes que HO− si ce solvant est lui-même une base dans l'eau (NH3, par exemple) et les acides plus forts que H3O+ si ce solvant est acide (acide éthanoïque, par exemple).
Dans tous ces cas, l'acide cède le proton à la base, selon la définition de Brønsted. Mais si la base accepte le proton qui n'a aucun électron, c'est qu'elle est en fait donneur d'électrons au proton, qui les accepte. L'acidité liée au proton peut être remplacée par celle où intervient une paire électronique cédée par la base, le rôle d'accepteur n'étant plus réservé au seul proton. On arrive ainsi à la définition du chimiste Gilbert Newton Lewis selon laquelle la base est un donneur d'une paire d'électrons et l'acide un accepteur d'une paire d'électrons.
MÉDECINE
Le pH sanguin oscille normalement entre 7,35 et 7,42. Il augmente au cours de l'alcalose (trouble de l'équilibre acidobasique de l'organisme dû à une perte sévère de suc gastrique – lors de vomissements importants, par exemple –, ou à un apport excessif d'alcalins – bicarbonate de soude, par exemple) et diminue au cours de l'acidose (trouble de l'équilibre acidobasique dû à une insuffisance rénale, un diabète sucré, une paralysie respiratoire, etc.).
Le pH urinaire varie de 5,2 à 6,4 en fonction du régime alimentaire, de la digestion et du travail musculaire. Il diminue au cours de la goutte, du diabète avec acidocétose et des maladies fébriles. Il augmente lors de l'hyperchlorhydrie gastrique, de certaines infections des voies urinaires (cystite, pyélonéphrite) et de l'alcalose métabolique.
BOTANIQUE
Le pH des sols conditionne en partie la répartition des végétaux. Les espèces dites indifférentes sont susceptibles de supporter de larges variations de pH. Les espèces acidophiles acceptent des sols très acides (4-5) [oseille, myrtille, Deschampsia flexuosa, azalée, rhododendron]. Dans les sols moyennement acides (5-6), on trouve la fougère grand aigle, la germandrée, la petite pervenche, le châtaignier, le sarrasin, le seigle. Parmi les espèces neutrophiles (pH voisin de 7), citons anémone, azaret, cerfeuil, parisette, ail des ours, benoîte, belladone. Les plantes basiphiles (ou basophiles) croissent dans des milieux au pH supérieur à 7 (clématite, buis, scabieuse, pas-d'âne).







