cinétique
(grec kinêtikos)
Étude des lois qui régissent la vitesse des réactions chimiques.
CHIMIE
Les réactions chimiques, que les lois de la thermodynamique permettent de prévoir, se font à des vitesses très variables : si certaines sont explosives, comme le « coup de grisou » dans les mines de charbon, et d'autres très rapides, comme la combustion du magnésium dans les lampes flash des photographes, elles peuvent aussi être longues ; c'est le cas de la cuisson des aliments, par exemple, et plus encore de leur digestion, dans laquelle interviennent des réactifs naturels contenus dans les sucs digestifs.
Objectifs de la cinétique chimique
Les réactions chimiques ne sont pas toujours rapides et immédiates. Par exemple, la combustion d'une allumette, qui est simplement le résultat de la réaction du bois avec l'oxygène contenu dans l'air, demande un certain temps ; une bûche dans la cheminée va mettre également un certain temps pour se consumer. D'une manière générale, les réactions d'oxydation sont relativement lentes.
Notion de vitesse de réaction chimique
Certaines réactions d'oxydation peuvent néanmoins être très rapides : l'essence brûle presque instantanément dans le cylindre d'une voiture ; de même une accumulation de gaz de ville dans une pièce mal ventilée peut provoquer de très graves accidents. Mais, dans ces deux cas, il a fallu provoquer une explosion ; en effet, la présence d'air au-dessus de l'essence, dans le réservoir d'une voiture, n'est pas suffisante : il faut l'action d'une étincelle électrique, provoquée dans le cylindre par une bougie, pour que l'explosion se produise.
Les réactions d'oxydation ne sont pas les seules qui peuvent se faire à des vitesses plus ou moins grandes : le plâtre met un certain temps pour prendre, et le ciment, pour durcir, en demande encore plus.
Pourquoi étudier la vitesse des réactions chimiques
L'étude des vitesses auxquelles se font les réactions chimiques est importante pour des raisons pratiques aussi bien que théoriques. Un cuisinier a besoin, par exemple, de connaître le temps de cuisson du plat qu'il veut préparer ; de même, un industriel qui veut fabriquer un produit chimique a besoin de connaître la durée des différentes réactions à la base du procédé qu'il envisage d'utiliser pour mieux calculer le prix de revient du produit et s'assurer une vente à un prix compétitif.
La transformation des espèces, au cours d'une réaction chimique, est généralement un processus très complexe à l'échelle atomique, dont la connaissance est l'aboutissement des recherches du spécialiste de cinétique chimique. L'étude détaillée du mécanisme d'une réaction permet de comprendre quelles en sont les étapes les plus rapides. Pour accélérer une réaction, il est nécessaire d'accélérer l'étape la plus lente (qui constitue le point d'engorgement du processus total) ; en revanche, pour ralentir une réaction (une corrosion, par exemple), il suffit de ralentir le plus possible une des étapes du processus.
Ainsi, la cinétique chimique, qui étudie les vitesses de réaction, a deux buts distincts : mesurer à l'échelle macroscopique le temps nécessaire à la réalisation d'une réaction chimique et obtenir des informations afin de connaître les mécanismes réactionnels à l'échelle microscopique.
Définition de la vitesse de réaction
Pour étudier les vitesses de réaction, il est nécessaire d'en donner une définition précise.
Dans un système dont la transformation relève d'une réaction chimique unique, et dont l'équation stœchiométrique est indépendante du temps, une vitesse de conversion est définie par la dérivée de l'avancement de réaction par rapport au temps : dx/dt.
Dans le cas où tous les constituants font partie d'une seule phase de composition identique, dans tout le volume réactionnel de valeur V, on définit une vitesse volumique de réaction, dite le plus souvent vitesse de réaction, à l'instant t, et on a :

n(B) est la quantité de B à l'instant t, [B] la concentration de B à cet instant, et v(B) le coefficient stœchiométrique de B dans l'expression choisie pour écrire le bilan de la réaction chimique (on rappelle que par définition [B] = n(B)/V).
Comme le rapport d[B]/v(B) a la même valeur quel que soit le constituant B envisagé d'une réaction donnée, par suite de la définition même des coefficients stœchiométriques, cette vitesse peut être déterminée à partir de l'évolution de la concentration d'un constituant B quelconque participant à cette réaction ; dans la pratique, on choisit le constituant dont la concentration est la plus facile à suivre.
Influence de la température et des concentrations sur la vitesse de réaction
Dans la plupart des réactions chimiques, la vitesse augmente rapidement avec la température et selon la concentration des constituants.
L'influence de la température
Parmi les facteurs qui conditionnent la vitesse d'une réaction, il en est au moins un qui est évident, même pour un non-chimiste : la température. Ainsi, la cuisson d'un aliment est d'autant plus rapide que la température à laquelle elle est effectuée est plus élevée (la réalisation des Cocotte-Minute est basée sur cette constatation : l'augmentation de la pression accroît la température d'ébullition de l'eau). Il faut, à 100 °C, environ trois minutes pour cuire un œuf (on peut schématiser cette cuisson en disant qu'il s'agit de la réaction de coagulation du blanc d'œuf). Mais l'alpiniste sait qu'en altitude, là où la pression atmosphérique est plus basse que dans la vallée, l'eau bout à une température moins élevée et que le temps nécessaire pour cuire un œuf à la coque est plus important.
Le coefficient de vitesse
La vitesse d'une réaction chimique double lorsqu'on augmente la température de 10 °C : cette règle est approximative, mais elle est d'un usage très pratique. Plus précisément, le Suédois Svante Arrhenius a établi expérimentalement, en 1889, une loi exponentielle, applicable à toutes les réactions : la vitesse est proportionnelle à un facteur, appelé coefficient de vitesse, qui s'écrit :
k = A e-E/RT
où A est une valeur caractéristique de chaque réaction (mais ne dépend pas de la température), R est la constante molaire des gaz parfaits, T est la température thermodynamique et E, énergie molaire d'activation ou plus simplement énergie d'activation, a une valeur pratiquement toujours comprise entre 80 et 250 kJ . mol−1, dépendant de la réaction envisagée.
L'énergie d'activation
Cette loi est interprétée en s'appuyant sur la théorie cinétique des gaz : l'énergie cinétique des molécules d'un ensemble donné, supérieure à une valeur donnée, croît exponentiellement avec la température.En effet, les molécules pouvant réagir sont celles qui ont une énergie supérieure à la valeur de l'énergie d'activation, et les molécules dont l'énergie est plus faible que l'énergie d'activation de la réaction ne peuvent réagir, mais il est possible d'en activer un certain nombre en augmentant la température ; c'est une activation thermique. Ce type d'activation est possible pour toutes les réactions chimiques ; elle est mise en jeu pour initier, par exemple, la combustion du magnésium d'une lampe flash en photographie grâce au courant de décharge d'un condensateur, qui apporte l'énergie thermique nécessaire par effet Joule.
Lorsqu'une réaction est exothermique
Dans le cas d’une réaction exothermique (qui produit de la chaleur), celle-ci provoque une augmentation de la température du milieu réactionnel, de sorte que la vitesse de réaction augmente et qu'à force de s'accroître elle peut aboutir à une réaction explosive. Dans la pratique, on comprend qu'il puisse y avoir un intérêt capital à refroidir le réacteur où se déroule la réaction pour évacuer la chaleur produite et éviter ainsi une telle explosion.
Lorsque la réaction est endothermique
Dans le cas d’une réaction endothermique (qui consomme de la chaleur), l'abaissement de la température du milieu réactionnel provoque une diminution de la proportion de molécules actives : la réaction peut même pratiquement s'arrêter ; il y aura intérêt, alors, à chauffer le réacteur pour que la réaction se poursuive.
L'influence des concentrations
L'expérience montre que la vitesse d'une réaction, à un moment donné, dépend généralement des concentrations des constituants de cette réaction à cet instant, et qu'elle est, de plus, proportionnelle à un facteur k, lequel est tributaire d'un certain nombre d'autres paramètres, comme la température, la pression, les concentrations initiales, etc. :
vitesse = kg(e[B]),
où e[B] désigne tout ou partie de l'ensemble des concentrations des substances présentes dans le milieu réactionnel (réactifs, produits, mais aussi éventuellement catalyseur, solvant) et g une fonction plus ou moins compliquée de cet ensemble, selon les cas.
L'ordre global de réaction
Il arrive que la vitesse d'une réaction
v(A) A + v(B) B +… → v(P) P + v(Q) Q +…,
prenne une forme simple du type :
(1) vitesse = k . [A]a . [B]b…,
où les exposants a, b… sont indépendants du temps et des concentrations, et généralement différents des coefficients stœchiométriques correspondants.
Dans le cas où la vitesse peut se mettre sous la forme (1), on dit que la réaction a un ordre global n défini par la relation :
n = a + b + …,
somme des exposants des concentrations dans l'expression de la vitesse.
Par exemple, pour la réaction des ions Br− sur les ions BrO3− en milieu acide :
5Br− + BrO3− + 6 H3O+ → 3Br2 + 9 H2O,
on trouve expérimentalement une vitesse telle que :
vitesse = k . [Br−]1 [BrO3−]1 [H3O+]2.
Les ordres partiels
Les exposants (a, b, etc.) sont appelés ordres partiels : dans l'exemple précédent, 1 est l'ordre partiel relatif aux ions Br− et aux ions BrO3−, 2 est l'ordre partiel relatif aux ions H3O+.
Les ordres partiels sont souvent égaux à 1 ou 2, mais, à la place des exposants entiers (tels que 1 ou 2 comme dans l'exemple précédent), on peut avoir des exposants fractionnaires et/ou négatifs : 1/2, −1.
Il peut aussi arriver que la concentration d'une espèce présente n'entre pas dans l'expression de la vitesse d'une réaction, c'est-à-dire que la vitesse soit indépendante de cette concentration : l'ordre partiel est nul dans ce cas.
Dans la pratique, on constate qu'il est rare de pouvoir exprimer la vitesse sous la forme simple (1). Tel est le cas de la réaction du brome avec l'hydrogène, étudiée par l'Allemand Max Ernst August Bodenstein en 1906 :
Br2 (g) + H2 (g) → 2HBr (g),
dont la vitesse, mesurée expérimentalement, s'écrit :
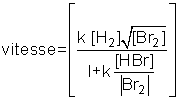
En présence d'une telle situation, on dit que la réaction n'a pas d'ordre, puisque la vitesse ne peut pas se mettre sous la forme (1) et qu'on ne peut définir de grandeur n.
Ordre de réaction
À une température fixée, un grand nombre de réactions se déroulent à des vitesses qui sont proportionnelles à la concentration d'un ou de deux réactifs.
Réactions d'ordre 1
Si une réaction
aA + bB = pP + qQ
a par exemple une vitesse de la forme vitesse = k [A], on peut écrire :
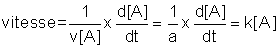
L'expression d[A]/[A] s'intègre facilement :
ln[A]/C0[A] = −k [A] t,
où [A] = C0 exp−k [A] t.
En posant ka = k [A] et en appelant C0[A] la concentration en A au temps t = 0. Il est possible de calculer la valeur de la concentration [A] au temps t en connaissant la concentration initiale et la valeur de k donnée par l'expérience.
Toutes les désintégrations radioactives obéissent à une telle loi exponentielle :
N(B) = N0(B)e−λt,
où N(B) est le nombre d'atomes B radioactifs au temps t et N0(B) correspond au nombre d'atomes B au temps initial et λ est appelé constante de désintégration radioactive.
Cette loi permet de prévoir qu'au bout d'un temps
t1/2 = (ln2)/λ
la moitié des atomes radioactifs se sont désintégrés.
Cette quantité, t1/2, s'appelle la période de demi-vie de B, ou période radioactive de l'atome B.
Application à la datation d'objets préhistoriques par le carbone 14
Williard Frank Libby a proposé une méthode de datation de résidus de végétaux ou d'animaux en se fondant sur la décroissance de leur concentration en carbone 14, isotope radioactif naturel du carbone dont la période est d'environ 5 640 ans.
L'isotope radioactif du carbone 14
Cet isotope radioactif provient du bombardement, par les neutrons produits par les rayons cosmiques, de l'azote des hautes couches de l'atmosphère selon la réaction :
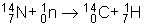
Ce carbone 14, et avec lui le carbone 12 stable, se combine avec l'oxygène de l'air, en proportions immuables depuis les temps préhistoriques, pour donner du dioxyde de carbone 14CO2, qui participe avec le dioxyde 12CO2 non radioactif à l'assimilation chlorophyllienne. Ainsi, les plantes et les organismes vivants ont une proportion toujours identique de 12C et de 14C.
La réaction de désintégration
Un gramme de carbone 14 se trouvant dans un tissu vivant émet environ 15 particules b par minute (une particule b n'est autre qu'un électron).
À la mort de l'organisme, les échanges avec l'atmosphère s'arrêtent et la quantité de carbone 14 diminue exponentiellement à cause de la réaction de désintégration qui produit un rayonnement b :

Le rapport de la mesure de la radioactivité du vestige à dater à celle d'un tissu vivant permet de connaître la date de mort de l'organisme.
Cette méthode devient imprécise avec la décroissance de la radioactivité du carbone 14 dans l'échantillon analysé : au-delà de 37 000 à 42 000 ans, on ne peut plus dater avec une précision suffisante. La datation sur des objets plus anciens nécessite un indicateur radioactif ayant une période plus grande. Les géologues ont ainsi pu estimer l'âge de la Terre (4,5 milliards d'années) en utilisant l'uranium 238.
Réactions d'ordre 2
Dans le cas n = 2, la vitesse est décrite par une loi d'un type tel que :
vitesse = k[A] [B] ou vitesse = k [A]2.
Ici, la variation de la concentration d'un réactif au cours du temps n'est plus exponentielle. Par exemple, dans le second cas, où la réaction est d'ordre 2 par rapport à l'un des réactifs, la décroissance de [A] est une fonction hyperbolique du temps. Le temps de demi-vie dépend cette fois de la concentration initiale C0[A] du réactif A :
t1/2[A] = 1/k[A]C0[A].
Les théories
Différentes théories ont été élaborées pour rendre compte de ces résultats. La plus simple est la théorie des collisions, qui repose sur le fait qu'il est nécessaire que les molécules se rencontrent (collision) pour qu'une réaction se fasse : plus leur concentration est grande, plus il y a de chances que la réaction se produise, d'où une loi de vitesse proportionnelle aux concentrations. Mais tous les chocs ne sont pas suivis d'une réaction, car il faut qu'au moment du choc les molécules soient orientées convenablement l'une par rapport à l'autre et qu'elles aient une énergie suffisante, d'où la notion d'énergie d'activation, seuil au-dessous duquel il ne peut rien se passer.
Les réactions composées
Les réactions isolées sont peu nombreuses. En général, les transformations chimiques résultent de la superposition ou de la succession de plusieurs réactions isolées.
Par exemple, la synthèse directe de l'ammoniac :
[N2 (g) + 3 H2 (g) ⇄ 2NH3 (g)].
Cette synthèse s'arrête avant que tous les réactifs soient totalement consommés : on peut l'expliquer en admettant que la réaction opposée entre en compétition avec la synthèse. Dans d'autres cas, plusieurs réactions compétitives ont lieu simultanément.
On peut également obtenir à l'issue d'une réaction des produits qui se transforment à leur tour (réactions successives).
On conçoit qu'on puisse obtenir des informations fondamentales sur le mécanisme des réactions chimiques à partir de l'observation des concentrations des espèces mises en présence, en fonction du temps.
Mécanismes réactionnels
L'équation d'une réaction chimique ne donne qu'un bilan : d'un côté s'écrivent les réactifs et de l'autre les produits de la réaction.
Quel est le processus qui permet la transformation au niveau moléculaire ? Quels sont les produits intermédiaires ?
Ce sont les questions que se pose effectivement le chimiste, car ce n'est que lorsqu'il connaîtra les détails de ce processus qu'il pourra agir : si une réaction est lente, il cherchera dans ces détails l'étape qui limite la vitesse ; en contournant l'étape lente, il pourra chercher le moyen d'accélérer la réaction globale en provoquant le passage par une autre voie. L'alpiniste ne fait pas autrement lorsqu'il cherche une voie vers le sommet, en contournant les difficultés trop grandes qu'il rencontre.
Réaction élémentaire
La réaction élémentaire est un acte chimique qui se produit, au niveau microscopique, entre particules spécifiées. Par exemple, la rencontre d'un ion H+ et d'un ion OH− conduit directement à une molécule d'eau.
On écrit :

La flèche arrondie spécifie qu'un doublet électronique, non engagé dans une liaison avec l'ion OH−, va assurer une liaison avec l'ion H+ auquel il manque, justement, un doublet pour être stable, donnant ainsi directement une molécule d'eau ; une telle réaction est dite élémentaire.
D'une manière générale, le chimiste cherche la suite des réactions élémentaires que choisit la nature et qui conduisent des réactifs aux produits.
La molécularité d'une réaction élémentaire est, par définition, le nombre de particules impliquées comme réactifs dans celle-ci ; ce nombre est évidemment un nombre entier. C'est ainsi que, dans la réaction élémentaire précédente, la molécularité est égale à deux : on dit que la réaction est bimoléculaire.
On peut parfois supposer des réactions trimoléculaires, mais celles-ci sont nécessairement beaucoup plus rares que les réactions bimoléculaires, parce que peu probables, exigeant la rencontre en même temps de trois particules. Les réactions peuvent être aussi monomoléculaires, si l'on admet qu'une particule peut se détruire spontanément, sans intervention d'une collision avec une autre.
Le mécanisme d'une réaction chimique
Pour établir le mécanisme d'une réaction chimique, il faut rechercher l'ensemble des réactions élémentaires dont la somme est effectivement cette réaction. Ensuite, c'est le calcul de la vitesse de chaque réaction élémentaire, puis celle de la vitesse globale, qui doit évidemment être en accord avec la vitesse expérimentalement observée. L'expérience montre que très peu de réactions se produisent en une seule étape. Lorsque c'est le cas, on parle d'une réaction simple. Telles sont les désintégrations radioactives, les réactions de dimérisation (par exemple: 2NO2 → N2O4), les réactions d'isomérisation et quelques autres.
L'établissement d'un mécanisme réactionnel repose sur :
– une simplicité des réactions élémentaires, qui conduise à des étapes dont la molécularité soit la plus faible possible ;
– le minimum de changement de structure à chaque étape, car la probabilité de rupture de plusieurs liaisons en même temps est faible ;
– la réversibilité macroscopique (l'expérience enseigne que le chemin suivi par une réaction élémentaire dans un sens est le même que celui qui est suivi dans le sens opposé).
Par exemple, la synthèse de l'ammoniac :
N2 + 3 H2 → 2NH3,
doit se faire en plusieurs étapes élémentaires, dont chacune ne réalise que le minimum de modifications :
N2 → 2N,
N + H2 → NH + H,
H + N → NH,
NH + H2 → NH3.
Pour s'assurer de la possibilité d'un tel mécanisme, il est nécessaire de chercher, et de trouver, la trace des espèces intermédiaires N, H, NH dans le milieu réactionnel.
Principales réactions élémentaires
Les réactions élémentaires peuvent être classées d'après leur nature, ce qui donne un nombre restreint de catégories.
La rupture de la liaison
La rupture d'une liaison peut se faire de deux façons. Dans la première, les deux électrons constituant cette liaison se séparent; chaque électron va avec un atome, c'est le cas de la molécule de brome, qui peut ainsi se séparer en deux atomes :
Br:Br → Br. + .Br.
Il s'agit d'une rupture homolytique, c'est une réaction radicalaire.
Dans la seconde, les deux électrons restent ensemble et partent avec un des atomes, le plus électronégatif, ainsi :
Cl:CH3 → Cl−: + CH3+.
Cette rupture hétérolytique est une réaction monomoléculaire, ionique.
La formation d'une liaison
La liaison peut se faire, également, de deux façons :
Br. + . CH3 → Br:CH3, réaction radicalaire,
H+ + OH– → H:OH, réaction ionique.
Ce sont, dans les deux cas, des réactions bimoléculaires.
On peut avoir aussi un transfert d’électrons d'une espèce sur une autre ; c'est donc une réaction bimoléculaire, par exemple :
Cl. + H2 → HCl + H., réaction radicalaire.
La réaction est dite de substitution dans le cas :
C2H5I + Br. → C2H5Br + I., réaction radicalaire.



