matière
(latin materia)

Substance constituant les corps, douée de propriétés physiques
PHYSIQUE
1. Qu'est-ce que la matière ?
La nature qui nous entoure, et dont nous faisons partie, offre à l'observation des réalités et des apparences, des substances et des phénomènes. Le magnétisme, cette capacité qu'ont les aimants de s'attirer ou de se repousser, est à ranger dans les phénomènes, mais on a pu se demander si l'aimant lui-même n'était pas une substance. Des interrogations tout aussi légitimes ont porté sur la chaleur, la lumière et l'électricité. La matière, en revanche, est sans hésitation possible le type même de la substance.
Elle est ce dont les corps sont faits, elle a des qualités et des propriétés, elle peut être le siège de divers phénomènes. En un sens, conformément à un usage bien établi, il y a plusieurs matières : un objet peut être en bronze ou en bois, en chêne ou en pin. Chaque variété de bois, chaque métal, a ses qualités propres. Mais ces matières – ces matériaux comme on dit aussi à propos des objets fabriqués, ces substances comme disent les chimistes – ont en commun d'être des variétés d'une seule et même substance, qui est ce que l'on appelle la matière.
Chacun sait qu'il y a des corps lourds, que certains sont chauds, bref que les corps ont des qualités plus ou moins définitives, plus ou moins changeantes. Quand toutes les qualités des corps viendraient à changer, quelque chose n'en subsisterait pas moins. C'est cette substance que la science appelle la matière et dont elle cherche, sinon la nature, du moins la constitution.
Au fil des siècles, la science s'est préoccupée de déterminer le plus possible de propriétés empiriques – ou macroscopiques – de la matière. Elle a eu à en chercher aussi la structure intime, ainsi que les propriétés de ses constituants, afin de pouvoir expliquer les différentes propriétés et les différents phénomènes dont la matière est le siège, telles la dureté et la chaleur. Ses succès remarquables ont, en un sens, déplacé le problème. Car la question est maintenant de savoir de quoi les particules élémentaires sont faites. Les seules réponses que l'on sache donner à cette question sont quasiment d'ordre mathématique.
2. Évolution de la conception de la matière
2.1. Les conceptions anciennes
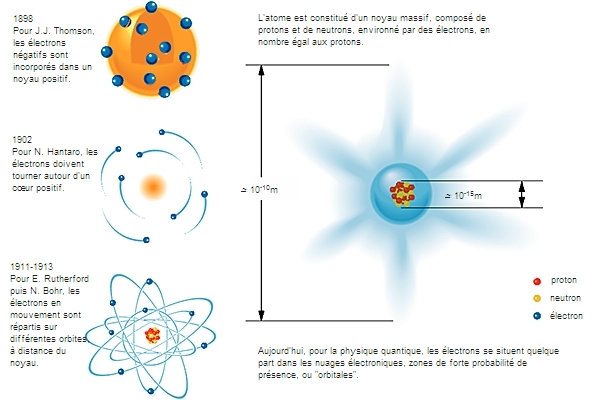
Les Grecs, dans leurs audacieuses spéculations, avaient proposé différentes conceptions de la matière. Pour certains, tels qu’Épicure (vers 341-270 avant J.-C.), puis Lucrèce (vers 98-55 avant J.-C.), il s'agissait de quelque chose de lacunaire, voire de particulaire ; pour d'autres, notamment Aristote (384-322 avant J.-C.), de quelque chose de continu. Rien n'avait véritablement permis de les départager sinon, au Moyen Âge, l'autorité reconnue par l'Université à Aristote.

La situation changea au début du xviie s. avec René Descartes (1596-1650). Celui-ci formula une doctrine mécaniste que l'on peut dire radicale. Non seulement la matière fut entièrement séparée de l'esprit, mais en outre elle ne devait plus avoir que le minimum le plus strict de qualités fondamentales : être étendue et divisible en parties susceptibles de se mouvoir, le mouvement devant suivre quelques lois extrêmement simples. Il s'agissait de rendre compte sur cette base de tout ce qui se rencontre dans la nature, par des explications données en termes de machineries, en quelque sorte. Le cartésianisme fut un temps de chasse aux qualités. Il ne niait pas que, dans les phénomènes, il puisse se rencontrer par exemple des attractions entre aimants, mais pas question d'y voir l'effet d'une vertu magnétique conçue comme qualité dernière. L'aimantation de la pierre de Magnésie était attribuée aux formes et aux mouvements d'une partie imperceptible de la matière. Quoique ce projet ait échoué, il avait marqué les esprits.
2.2. Du xviiie s. à nos jours

Petit à petit, il fallut admettre d'autres propriétés fondamentales de la matière. Isaac Newton (1643-1727) notamment, démontra que deux corps s'attirent toujours, quoique l'on n'ait jamais réussi à imaginer un mécanisme expliquant ce phénomène et les lois qui le régissent. La notion même de masse, déjà, ne se laisse guère expliquer en termes mécanistes. La masse a dû être acceptée comme qualité première, tandis que le poids devenait un simple phénomène, explicable par les masses et les forces de gravitation. Ces forces à distance, à l'existence bien établie, valurent un embarras certain à leurs premiers défenseurs, parce qu'elles semblaient réintroduire les qualités occultes.
C'est dans le cadre d'un mécanisme relatif, comme à regret, que les physiciens puis les chimistes ont emboîté le pas à Galilée (1564-1642). Reprenant la démarche qui avait réussi à Archimède en statique, celui-ci avait montré comment concentrer l'interrogation de la nature sur les grandeurs que l'on peut définir : longueurs, vitesses, poids, etc. Les physiciens inventèrent ainsi la température, au xviiie s., en la distinguant de la chaleur. Ils firent ensuite de celle-ci l'une des formes de l'énergie, nouvelle grandeur douée comme la masse de la propriété d'invariance : dans un système isolé, elle se conserve en quantité même si elle change de forme.
Un nouveau virage intervint au début du xxe s., où matière et énergie étaient encore considérées comme deux concepts indépendants, à l'origine de tout phénomène physique. En effet, la théorie de la relativité restreinte d’Einstein, formulée en 1905, permit de regrouper ces deux concepts par la célèbre relation d’équivalence entre la masse et l’énergie : E = mc2. Puis se développa la physique quantique, sous l’impulsion notamment de Max Planck, qui accentua le bouleversement de notre conception de la matière : la matière, à son stade ultime de particule élémentaire, peut être considérée comme une perturbation de l’espace-temps.
3. Les états de la matière
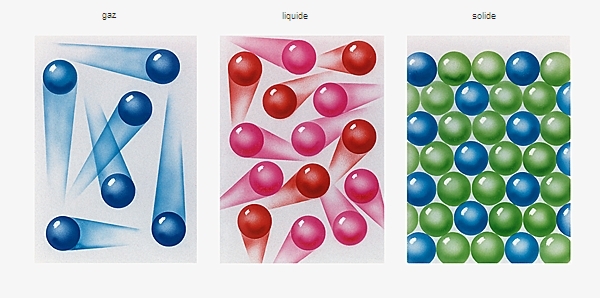
De manière générale, la matière peut être solide ou fluide. Les corps solides conservent leur forme, tandis que celle des fluides s'adapte au récipient qui les contient. Parmi les fluides on distingue les liquides et les gaz : ces derniers peuvent être aisément comprimés. La matière se présente donc généralement sous trois états physiques : solide, liquide ou gazeux. De très nombreux genres de corps peuvent passer par ces trois états, selon les conditions. On sait bien que l'eau peut devenir glace comme elle peut devenir vapeur. Il suffit que la température varie. Les changements d'état d'un corps peuvent aussi résulter des variations de la pression.
Par ailleurs, il existe des états particuliers, comme l’état de plasma (gaz partiellement ou totalement ionisé), l’état superfluide (viscosité nulle), l’état supraconducteur (résistance électrique nulle) ou encore l’état de condensat de Bose-Einstein (atomes dans le même état quantique d’énergie minimale), qui nécessitent un formalisme quantique complexe.
La physique a établi, pour chaque substance et dans chacun des états, diverses propriétés quantitatives : masse volumique, densité, température de fusion à la pression atmosphérique, etc. La chimie a poursuivi de son côté l'idée qu'il se produit, lors d'une réaction, des changements qui affectent la matière plus profondément que ne le font les simples changements d'état. En d'autres termes, elle a fait sienne l'enquête sur la nature de chaque matière. Une fois devenue attentive elle aussi aux aspects quantitatifs des choses, elle a pu établir que la masse totale des corps se conserve au cours de toute réaction. La physique, peu après, affirma un principe de conservation de portée encore plus grande pour l'énergie, notion qui en est venue ainsi à concurrencer celle de matière.
4. La structure intime de la matière
La chimie, au début du xixe s., a commencé à donner une forme élaborée à l'une des vieilles conceptions de la matière, l'atomisme. L’histoire attribue généralement à Démocrite l'idée que la matière pouvait être composée de corpuscules insécables , plus ou moins semblables les uns aux autres, et que toutes les propriétés de la matière devaient pouvoir s'expliquer par leurs divers arrangements. Toutefois, il semblerait que Démocrite ne soit pas le matérialiste qu’on a l’habitude de décrire et que l’atomisme soit plutôt porté par Épicure puis par son disciple Lucrèce. Les chimistes, tout un siècle durant, tâtonnèrent à la recherche d'une théorie apte à rendre compte de tous les faits, qualitatifs et quantitatifs. Les physiciens prirent le relais à la fin du xixe s., et révélèrent enfin la structure générale de la matière.
4.1. Les atomes
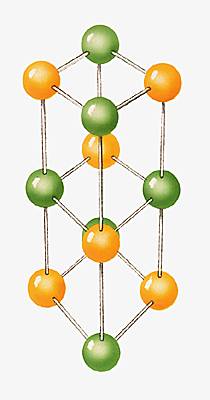
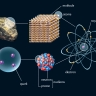
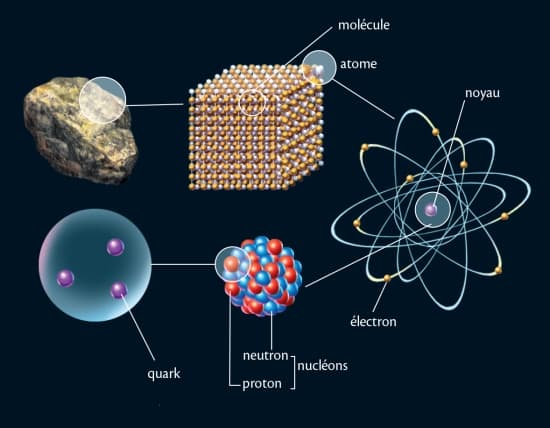
Les atomes d'un même élément, le néon (Ne) par exemple, peuvent rester isolés les uns des autres. La plupart s'associent, en molécules ou bien en cristaux. Ainsi l'eau est-elle composée de molécules comportant chacune deux atomes d'hydrogène et un d'oxygène (H2O). Un cristal est constitué de nombreux atomes disposés de manière tout à fait régulière. Le chlorure de sodium, par exemple, c'est-à-dire le sel de table, est fait d'atomes de chlore (Cl) et d'atomes de sodium (Na) en nombre égal, rangés selon un ordre répétitif et rigoureux.
Dans une molécule, comme dans un cristal, les atomes restent ensemble sous l'effet des forces qu'ils exercent les uns sur les autres. Il s'agit de forces électriques dues à la présence de charges. Elles sont présentes dans tout atome, quoique celui-ci, au total, soit électriquement neutre.
Ces forces s'exercent aussi entre les molécules, plus ou moins selon les circonstances, ce qui explique les états physiques. Fortement liées entre elles, les molécules ne peuvent pas bouger les unes par rapport aux autres : le corps est solide. Totalement libres au contraire, elles se déplacent à grande vitesse et dans tous les sens : le corps est gazeux. Ces mouvements se produisent au milieu de beaucoup de vide, ce qui explique qu'un gaz puisse voir son volume réduit par compression. Le liquide est la situation intermédiaire où les forces s'exercent suffisamment pour limiter la liberté, mais pas assez pour empêcher un glissement relatif des molécules.
Quant à la température on l'explique, dans les trois états, par le degré d'agitation des atomes et des molécules.
4.2. Les noyaux atomiques
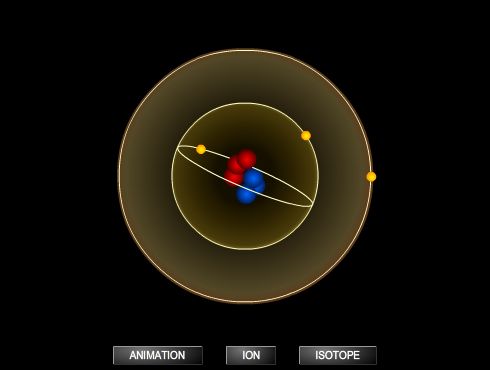
Les atomes sont tous composés d'un noyau autour duquel gravitent des électrons. Les nucléons, c'est-à-dire les constituants du noyau, sont des protons et des neutrons. Tous ont une masse. Protons et électrons portent en outre des charges électriques, égales et de signes opposés. Au sein du noyau, les protons, chargés positivement, devraient se repousser. Or l'attraction universelle est bien trop faible pour compenser la force électrique. C'est une autre force, l'interaction forte, qui retient les nucléons groupés.
Un atome peut s'ioniser, c'est-à-dire perdre ou gagner un ou plusieurs électrons. L'ionisation est un aspect important des atomes pour la chimie : de la capacité des atomes à s'ioniser dépend dans une large mesure l'aptitude des corps à réagir ou pas les uns avec les autres.
Dans des conditions extrêmes, les atomes peuvent même perdre tous leurs électrons. On obtient alors un plasma, considéré comme un quatrième état de la matière. Les étoiles, autrement dit la plus grande partie de la masse de l'Univers, sont à l'état de plasma.
4.3. Les particules
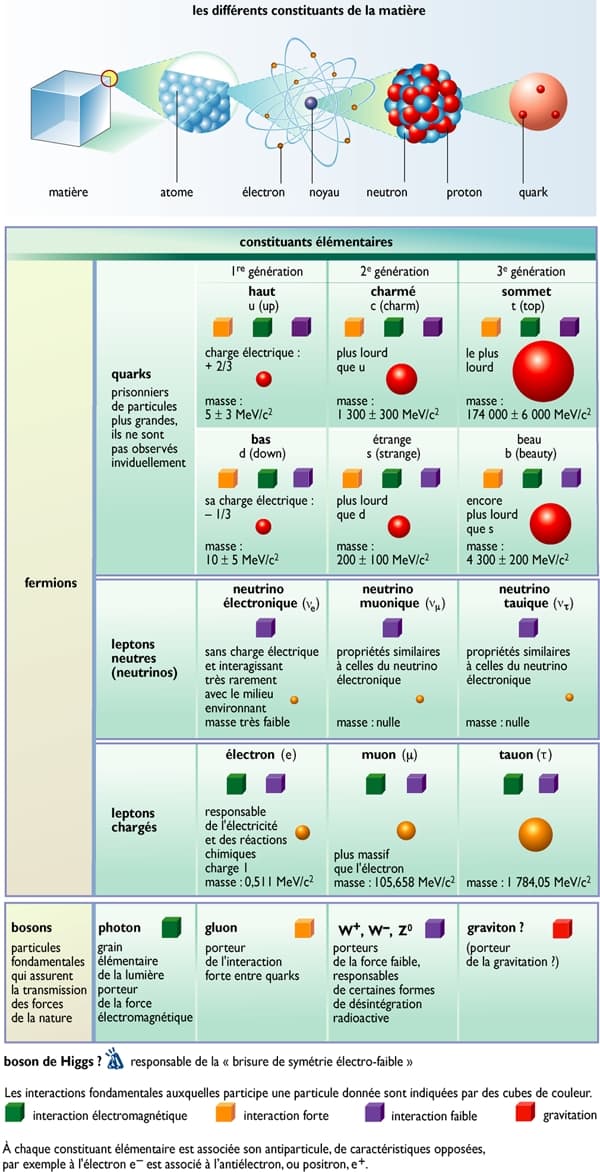
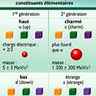
Les nucléons eux-mêmes se sont révélés être des particules composées par d’autres particules plus élémentaires encore : les quarks. La théorie des quarks a été élaborée puis confirmée expérimentalement dans la seconde moitié du xxe s. Elle consiste à expliquer l'existence et les propriétés des protons et des neutrons, et, avec eux, de toutes les particules que l'on place dans la catégorie des hadrons, par les combinaisons de six types de quarks, aussi appelés « saveurs ». Chacun est désigné par une lettre : u (up), d (down), c (charm), s (strange), t (top), b (bottom). Les quarks sont caractérisés par leur masse et leur charge électrique, mais aussi par d'autres paramètres tels que leur couleur. Le proton correspond à la combinaison uud, et le neutron, à udd. L'électron n'est pas concerné car il n'est pas de la famille des hadrons mais de celle des leptons, qui compte six particules (l’électron, le neutrino électronique, le muon, le neutrino muonique, le tau, et le neutrino tauique).

On a ainsi les douze particules élémentaires du modèle standard. Et la masse de ces douze particules fait intervenir une seule particule : le boson de Higgs, très probablement détecté en 2012 dans le grand collisionneur de hadrons (LHC) du Cern, près de Genève..
4.4. Formes et apparences de la matière
La matière était initialement regardée comme ce dont les corps « sensibles » sont faits. Elle était conçue comme une substance, opposée en cela aux phénomènes. De ces derniers, comme pour le magnétisme, on pouvait espérer trouver une explication qui les aurait réduits à un statut d'illusions inévitables. Or la matière n'est pas que formes et mouvements, c'est aussi de la masse ainsi qu'une capacité attractive liée à celle-ci. L'électricité, en revanche, n'apparaissait liée à la matière que de façon accidentelle. Il fallait électriser un corps pour qu'il portât une charge. Tout cela reste vrai lorsque l'on prend les choses au niveau de nos sens. Mais lorsque le regard pénètre plus en profondeur, grâce à tout l'arsenal de la science, expérimental et théorique à la fois, cet ordonnancement doit laisser place à d'autres, plus complexes.
4.5. Matière et ondes
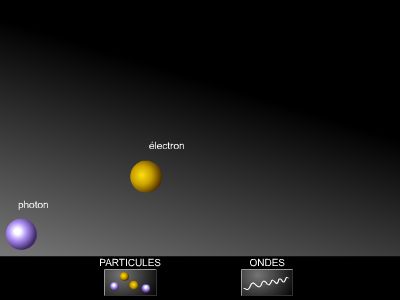
La mécanique rationnelle de Newton, science des mouvements et de leurs rapports avec les forces, avait obtenu de beaux succès à l'échelle macroscopique, tout particulièrement dans l'étude du Système solaire. Pour l'atome isolé et pour ses constituants, il a fallu l'abandonner au profit de la mécanique quantique. Un des aspects majeurs de celle-ci est que toute particule se voit associer une onde, tout comme l'onde électromagnétique s'était vue associer une particule, le photon. L'opposition de la matière et de la lumière en a été sensiblement réduite ; la barrière qui les sépare peut être repérée dans les caractéristiques du photon. Notamment, bien qu'il ait une quantité de mouvement et une énergie, celui-ci n'a pas de masse. La mécanique quantique, en même temps, a limité drastiquement les espoirs de pouvoir acquérir une connaissance expérimentale aussi fine que voulue de l'infiniment petit : ce qui se gagne en précision dans la connaissance d'une grandeur (position, temps) ne peut que se perdre sur une autre (vitesse, énergie).
4.6. Matière et énergie
Une autre mécanique, celle de la relativité restreinte, nécessaire lorsque les particules sont animées de grandes vitesses (proches de celle de la lumière), a annoncé que la matière ne devait pas être opposée à l'énergie de manière trop tranchée. Plus exactement, la masse, qui passait auparavant pour la grandeur la plus caractéristique de la matière, peut se transformer en énergie (selon la célèbre formule d’Einstein : E = mc2). La technique des explosifs nucléaires et thermonucléaires témoigne de la justesse de cette conception, de sorte que la matière n'a pu conserver un statut de véritable substance.
Pis encore, lorsque de l'énergie se transforme en matière, il y a création simultanément d'antimatière. Le phénomène se produit dans le cosmos, ou bien à l'occasion de collisions dans les accélérateurs de particules. Pour chaque particule il existe une antiparticule, de même masse mais de charge électrique opposée : le positon (ou positron), par exemple, pour l'électron. L'antiparticule est détruite par la rencontre de sa particule associée, aussi ne peut-elle exister que pendant un temps extrêmement bref. Ainsi la matière se trouve-t-elle doublée, au moins sur un plan théorique, par quelque chose dont on ne sait trop s'il faut en parler comme d'une autre substance.
Mais le plus grand mystère concernant la matière est le fait que celle-ci représente moins de 5 % du total masse/énergie de l’Univers ! En effet, l’Univers serait également composé d’environ 25 % de matière noire de nature inconnue et de 70 % d’une d’énergie noire tout aussi mystérieuse…
4.7. Matière et interactions
L'analyse de la matière, depuis la découverte de la gravitation universelle jusqu'à nos jours, a constamment donné le beau rôle aux interactions, c'est-à-dire aux forces qui s'exercent entre les corps. La physique tend à réduire le nombre de celles-ci. Déjà l'interaction électromagnétique et l'interaction faible, propre aux particules à faible durée de vie, ont pu être réunies en une seule théorie, celle de l'interaction électrofaible, et les théoriciens espèrent bien parvenir à une théorie qui la réunirait aux deux autres, l'interaction forte et l'attraction universelle.
→ interactions fondamentales, gravitation.
Mais quelle que soit l'unité que l'on puisse mettre dans ce domaine, il faut tenir compte d'une nouvelle réalité, bien établie désormais : le phénomène de l'interaction entre deux particules A et B s'accompagne de l'échange, entre A et B, d'une troisième, à durée de vie limitée, désignée de manière générique sous l'appellation de boson vecteur. Celui de l'attraction universelle, qui n'a pas encore été mis en évidence expérimentalement, serait le graviton. Ainsi la distinction entre particules et interactions est devenue de plus en plus floue.
5. La nature de la matière
5.1. Une définition de plus en plus complexe
Au point où sont parvenues les sciences de la nature, la matière est une notion qui a perdu une partie de son importance au bénéfice de l'énergie, de l'interaction, de l'antimatière, voire du vide. Ce dernier s'est révélé posséder tant de propriétés qu'il est presque permis d'y voir une substance, moins évanescente, en un sens, que la matière.
→ vide.
À la question de savoir ce qu'est la matière, il n'est plus guère possible de donner une réponse unique. Il faut que la question soit précisée par l'indication du niveau visé (macroscopique, atomique ou particulaire). Une réponse simplifiée consiste à dire qu'elle est un assemblage de particules ; la propriété qui assure le mieux leur unité étant la masse.
5.2. Au carrefour de plusieurs sciences
L'étude de la matière est une tâche répartie entre différentes sciences de la nature. Si la physique a été la première héritière de la philosophie naturelle, la chimie l'a suivie et l'on a d'abord eu l'impression qu'elles pouvaient se répartir les rôles. Cette dernière se réservait la question de la nature intime de la matière, de ce qui fait que le bronze n'est pas le fer. Mais la chimie s'est vue en quelque sorte contournée : elle est science des molécules et autres arrangements d'atomes. Elle étudie les transformations au cours desquelles les atomes, ou du moins les noyaux, conservent leur intégrité. Dès qu'il n'en va plus ainsi, on parle de physique nucléaire et, au niveau inférieur, de physique des particules. Même la science de l'atome, indépendamment de toute transformation, est plutôt cataloguée comme physique atomique, malgré tout ce qu'elle doit aux efforts des chimistes du xixe s. D'un point de vue théorique, la chimie n'est qu'une branche spécialisée de la physique. Quant à la biologie prise dans son unité, elle vise elle-même à n'être qu'une branche spécialisée de la physique-chimie, celle qui se consacre à l'étude des phénomènes de la vie. Les chimistes, mais aussi des biochimistes et des astrochimistes, ont mis à mal l'idée d'une nature propre à la matière vivante, en réalisant notamment des synthèses de substances organiques. Si le passage de l’inerte au vivant reste encore une énigme, celle-ci semble de plus en plus à portée de main.