réaction chimique
[dossier]

Résumé du dossier
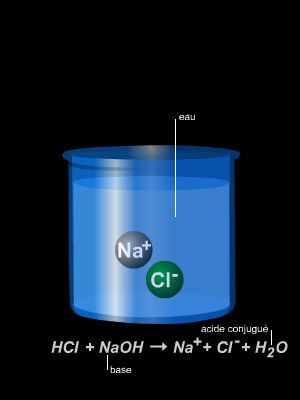

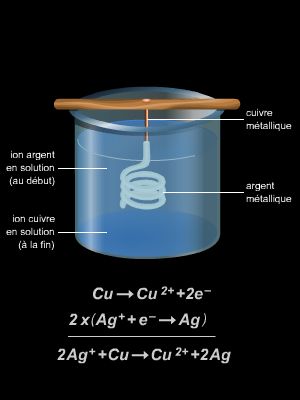
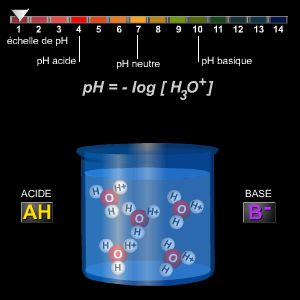

Une réaction chimique est une transformation au cours de laquelle des corps disparaissent (les réactifs) et d’autres apparaissent (les produits). Au cours d’une réaction chimique, les molécules qui composent les réactifs se cassent et libèrent leurs atomes. Ceux-ci se regroupent autrement et forment d’autres molécules, qui, constituent les produits. Au cours de la réaction, les atomes se conservent donc. L’équation-bilan permet de traduire la réaction. Celle-ci s’écrit en plaçant à gauche les réactifs et à droite les produits et en équilibrant ensuite par des coefficients devant chaque formule afin que le nombre d’atomes de chaque espèce soit le même des deux côtés de la flèche. Certaines réactions produisent de la chaleur, elles sont dites « exothermiques », d’autres en nécessitent ou en absorbent, elles sont dites « endothermiques ». Les combustions sont des réactions chimiques, où un combustible s’unit à un comburant (souvent l’oxygène) en produisant de la chaleur. Si la combustion est très rapide, le dégagement de chaleur est suffisant pour porter le combustible à incandescence. On dit qu’il y a alors combustion vive. Si la combustion est lente, on dit qu’il y a oxydation, comme dans le cas du fer en présence d’air humide. Si le mélange combustible-comburant est riche en oxygène, la combustion sera complète. Si au contraire ce mélange est trop pauvre en comburant, la combustion est incomplète. Plus généralement on parle d’oxydation quand la réaction fait perdre des électrons à un atome. L’opération inverse s’appelle une réduction. Quand une action chimique d’un oxydant sur un réducteur comporte à la fois une réduction de l’oxydant et une oxydation du rédacteur on parle d’oxydoréduction. Dans la réaction 2CuO + C → 2Cu + CO2, on assiste simultanément à l’oxydation du carbone et à la réduction de l’oxyde de cuivre. Le cuivre est l’oxydant et le carbone le réducteur.














