aluminium
(mot anglais, de alumina, terre d'alun)

Métal blanc, léger, le plus employé après le fer. (Élément chimique de symbole Al.)
- Numéro atomique : 13
- Masse atomique : 26,98
- Température de fusion : 660 °C
- Masse volumique : 2,7 g/cm3
L'aluminium, isolé par Œrsted en 1825 et par Wöhler en 1827, est fabriqué industriellement depuis 1854, grâce à Sainte-Claire Deville ; sa métallurgie par électrolyse a été mise au point en 1886, simultanément par Héroult et Hall.
Chimie de l'aluminium
L'aluminium à l'état pur est mou et très malléable. Oxydable, il ne s'altère pas à l'air car il est protégé par une mince couche d'alumine. Il est dissous par la soude et la potasse, en donnant des aluminates. Parmi ses composés, le plus important est son oxyde, l'alumine. Le fluorure AlF3 existe sous forme de sel complexe, la cryolite, Na3[AlF6]. Le chlorure AlCl3 est employé en chimie organique comme catalyseur. Le sulfate Al2(SO4)3 sert à l'encollage du papier, au tannage des peaux et au mordançage des tissus. Les silicates d'aluminium sont très abondants dans la nature, en général combinés à des oxydes alcalins ou à la chaux (feldspaths, mica, argiles, zéolites, etc.). L'aluminium représente 8,5 % du poids de l'écorce terrestre.
Métallurgie
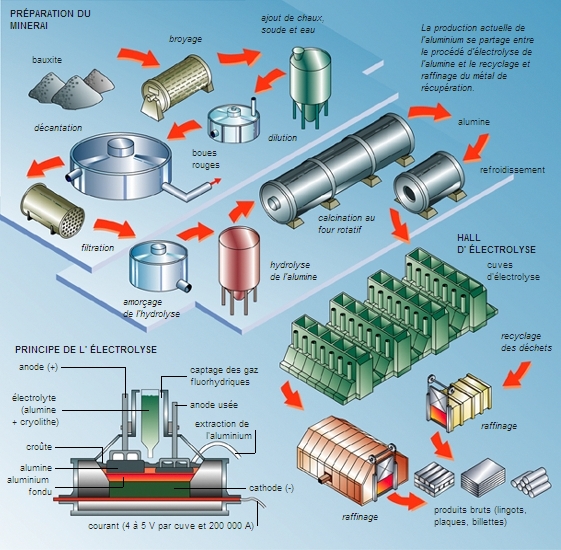
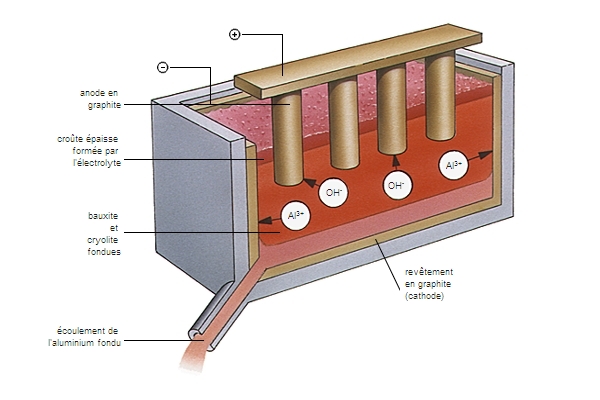
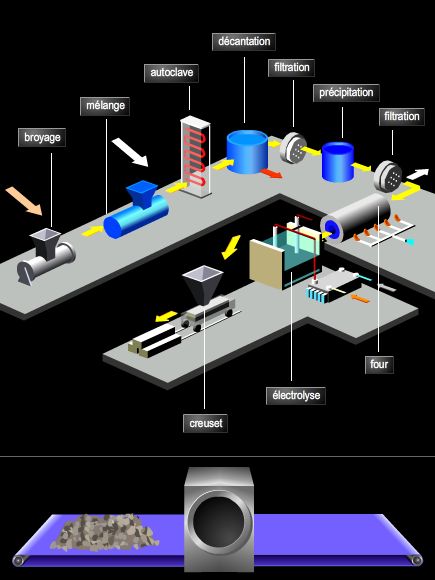
La métallurgie de l'aluminium est fondée sur la réduction électrolytique de l'alumine obtenue à partir de la bauxite. L'alumine dissoute dans la cryolite fondue est soumise, à haute température, à l'action d'un courant électrique continu. Pratiquement, on a un dépôt d'aluminium fondu sur le fond de la cuve (cathode) et un dégagement d'oxygène sur l'anode en charbon, qui est oxydée. L'aluminium ainsi obtenu titre 99,5 à 99,8 %. On prépare l'aluminium raffiné à 99,99 % et plus par un raffinage électrolytique ou par ségrégation.
Utilisations
Le métal pur est utilisé pour sa grande conductibilité électrique et thermique (condensateurs, réflecteurs) ainsi que pour sa bonne tenue à l'air et à certaines corrosions courantes (feuilles minces pour l'emballage ; articles ménagers ; industries chimique et pharmaceutique ; construction automobile, où son emploi tend à croître). Les alliages d'aluminium ont une faible masse volumique, des résistances mécaniques moyennes et fortes et une bonne tenue à certaines corrosions. L'alliage avec le cuivre et le magnésium (Duralumin) peut subir un traitement de durcissement structural (trempe et maturation) qui le fait utiliser dans l'aviation. Ce secteur se tourne également vers le nouvel alliage aluminium-lithium, qui devrait permettre un allègement de 10 à 15 % des structures. Sous forme de pièces de fonderie, l'alliage aluminium-silicium est utilisé pour la confection de blocs-moteurs et de pistons d'automobile. Enfin, il tend à se répandre dans le bâtiment, aussi bien pour les cadres de fenêtres qu'au sein de grandes réalisations architecturales (Institut du monde arabe à Paris).
Production
La production de l'aluminium nécessite une grande quantité d'électricité, si bien qu'elle est localisée soit près de grandes sources d'énergie soit à proximité des marchés de consommation. En croissance continue, la production mondiale est de l'ordre de 38 millions de tonnes par an. Les premiers producteurs sont la Chine (plus du quart mondial), la Russie, le Canada et les États-Unis, devant l'Australie, le Brésil, l'Inde et la Norvège. En 2008, la baisse de la demande, dans les transports et la construction notamment, a accru très sensiblement les stocks et fait chuter les prix.
Aspects médicaux et environnementaux
L'aluminium médicamenteux est une substance entrant dans la composition de pansements et d'antiacides digestifs. Il se présente sous forme de phosphate ou d'hydroxyde, éventuellement associé à d'autres produits tels que le magnésium. Ses propriétés antiacides le font prescrire pour le traitement d'appoint des douleurs de l'estomac et de l'œsophage. Ses effets indésirables sont une constipation et une diminution de l'absorption digestive du phosphore alimentaire ou de certains médicaments.
Toxicité. L'aluminium aurait des effets toxiques sur le système nerveux central. Cette neurotoxicité a été observée chez des personnes dialysées (eau de dialyse contaminée par l'aluminium), atteintes d'encéphalopathies. Les liens entre les expositions à certaines concentrations d'aluminium et l'apparition de démences ne sont cependant pas clairement établis. L'utilisation de l'aluminium est donc limitée dans les ustensiles de cuisine, les conduites d'eau, etc.
Pollution. La production d'aluminium peut provoquer divers types de pollution liés au fluor utilisé dans les réactions ou aux rejets de gaz. Le risque majeur reste celui des « boues rouges » produites lors de la synthèse d'alumine à partir de bauxite. En octobre 2010, une usine située à Ajka, près de Budapest, a déversé, après rupture d'une cuve, plus de 500 000 m3 de ces boues rouges toxiques et corrosives causant la mort de 9 personnes et la destruction de l'écosystème proche.