pile
(latin pila, pilier)

Appareil transformant directement en énergie électrique l'énergie développée dans une réaction chimique.
ÉLECTRICITÉ
Les piles électriques
La pile de Volta
L'association de deux électrodes et de leurs solutions respectives constitue une pile électrochimique. Historiquement, cette dénomination provient de la première réalisation d'un tel dispositif par Alessandro Volta, en 1800, grâce à l'empilement de séries de disques de cuivre et de zinc en contact direct, chaque couple de disques zinc-cuivre étant séparé par une rondelle de carton humide.
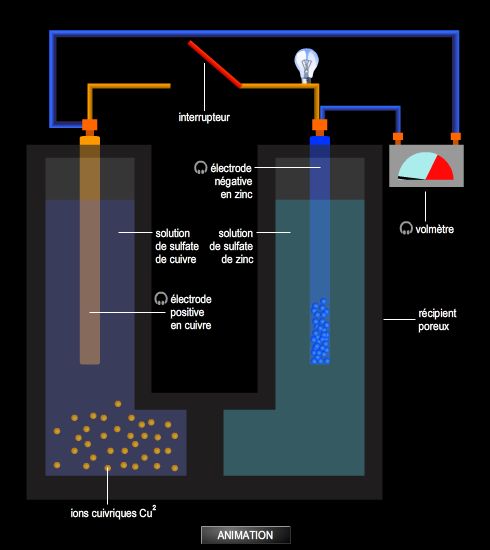
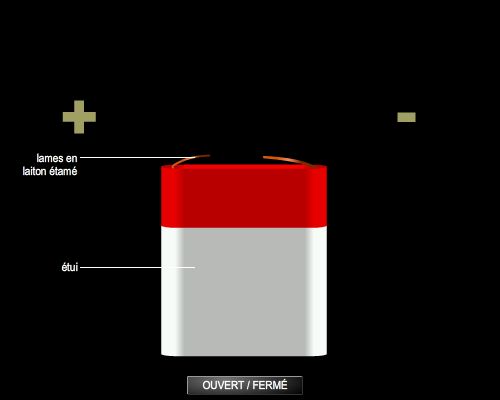
La pile Daniell
Inventée en 1836 par John Frederic Daniell, elle est constituée par une lame de cuivre et une lame de zinc, chacune plongeant dans une solution de l'un de ses sels. Par suite de l'existence de la différence de potentiel métal/solution, lorsque les deux compartiments communiquent par une jonction électrique, il s'établit une tension entre les deux conducteurs métalliques. Quand la pile fonctionne, le courant va du pôle + au pôle −, ce qui correspond à une circulation d'électrons en sens inverse. Au total, il y a dépôt de cuivre et dissolution du zinc, selon la réaction globale : Cu2+ + Zn → Zn2+ + Cu. C'est la réaction qui se produit spontanément si on trempe une lame de zinc dans une solution d'ions cuivriques. Mais l'intérêt du montage précédent est de permettre la récupération de l'énergie de cette réaction sous forme d'électricité. (→ électrochimie.)
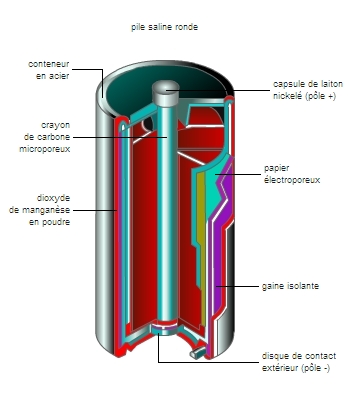
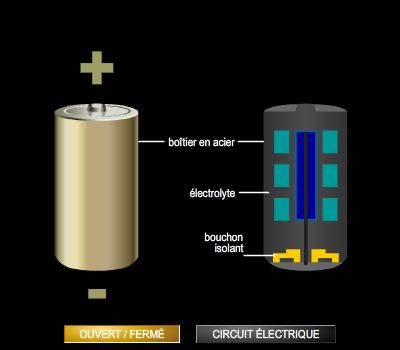
La pile Leclanché et ses variantes
Les piles les plus utilisées sont les piles du type Leclanché, mises au point en 1868 par l’ingénieur français Georges Leclanché. Elles sont constituées par une électrode zinc (pôle négatif) en contact avec une solution gélifiée de chlorure d'ammonium. Le pôle positif est une tige de carbone aggloméré avec un oxydant, le bioxyde de manganèse. La force électromotrice obtenue est voisine de 1,5 V.
De nombreuses variantes de piles existent : piles alcalines, piles au mercure, etc. Toutes ont cependant en commun de ne pas être rechargeables.
Les piles rechargeables
Le développement des appareils de photo numérique, des lecteurs de musique MP3, des téléphones et des ordinateurs portables s'accompagne d'un essor des « piles » rechargeables, qui sont en fait des accumulateurs (ou batteries) miniaturisés, dont il existe différents types : nickel-cadmium, nickel-métal-hydrure, lithium-ion, lithium-polymère.
La pile à combustible
Historique
Dans son principe, la pile à combustible repose sur la réaction inverse de l'électrolyse de l'eau (décomposition en hydrogène et oxygène par un courant électrique) : l'oxydation de l'hydrogène produit de l'eau et de l'électricité. Le principe de ce type particulier de pile électrique a été découvert en 1802 par le Britannique Humphry Davy et c'est son compatriote William Robert Grove (1811-1896) qui a construit, en 1839, la première cellule combinant l'hydrogène et l'oxygène. Les premières piles à combustible opérationnelles ont été réalisées au milieu du xxe s. aux États-Unis, et ont été utilisées comme générateurs électriques pour les vaisseaux spatiaux habités américains (programmes Gemini et Apollo). Elles ont connu ensuite d'autres applications, notamment dans le domaine militaire.
Perspectives
Aujourd'hui, avec l'attention portée à la protection de l'environnement et les craintes suscitées par l'appauvrissement progressif des ressources énergétiques fossiles, la pile à combustible fait l'objet d'intenses recherches. Non polluante (pas de rejets de gaz à effet de serre), silencieuse et d'un excellent rendement énergétique, elle présente d'importants atouts pour contribuer, dans le futur, à la production d'énergie (électricité et chaleur) et à la propulsion des véhicules automobiles. Cependant, c'est un dispositif qui reste pour l'instant très coûteux.
L'un des modèles de pile à combustible les plus étudiés aujourd'hui est la pile à membrane échangeuse de protons. Elle comprend deux électrodes minces et poreuses séparées par une membrane de polymère qui ne laisse passer que les protons. Des catalyseurs recouvrent une face de chaque électrode. Quand l'hydrogène entre dans le dispositif, il est décomposé en électrons et en protons par le catalyseur qui recouvre l'anode. Les électrons circulent dans un circuit externe et actionnent un moteur électrique, tandis que les protons migrent à travers la membrane jusqu'à la cathode. Le catalyseur qui recouvre la cathode combine les protons avec les électrons qui, avec l'oxygène de l'air, forment de l'eau.














