zinc
(allemand Zink)

Métal blanc bleuâtre, peu altérable, susceptible d'un beau poli. (Élément chimique de symbole Zn.)
- Numéro atomique : 30
- Masse atomique : 65,37
- Masse volumique : 7,14 g/cm3
- Température de fusion : 419 °C
- Température d'ébullition : 907 °C
Historique
Les laitons, obtenus par mélange de minerais, sont connus en Orient depuis l'Antiquité. Jusqu'au xviiie s., le zinc était, en Europe, importé des Indes et de la Chine, sous le nom d'étain des Indes. Paracelse l'étudia et lui donna son nom, dérivé d'un mot allemand signifiant étain. La première usine occidentale de production du métal selon les méthodes chinoises entra en service à Bristol (Grande-Bretagne) en 1743. Le zinc a été isolé pour la première fois en 1776 par le chimiste allemand Andreas Sigismund Marggraf (1709-1782).
Propriétés physico-chimiques
Le zinc est un solide blanc, cassant à froid, malléable et ductile entre 100 °C et 150 °C. C'est un métal réducteur amphotère. Assez électropositif, il est facilement attaqué par les acides, avec production d'hydrogène pour les acides non oxydants. Il déplace de leurs solutions salines les métaux moins électropositifs (cuivre, plomb, argent). À l'air humide, il se couvre d'une couche protectrice d'hydrocarbonate. L'oxyde ZnO est une poudre blanche, employée sous le nom de blanc de zinc (peintures, industrie du verre, etc.). Oxyde amphotère, il se combine aux acides pour donner des sels de zinc et aux alcalis pour donner des zincates.
Le chlorure ZnCl2 est utilisé contre la putréfaction du bois ; le sulfure ZnS, blanc, existe dans la nature sous forme de blende ; le sulfate ZnSO4 est employé pour le traitement des eaux industrielles et dans l'industrie pharmaceutique.
MÉTALLURGIE
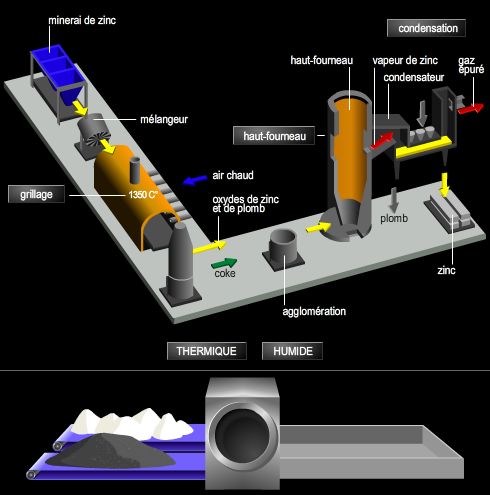
Deux groupes de minerais sont exploités : les minerais oxydés, type calamine (carbonate et silicate de zinc), et surtout les minerais sulfurés, type blende (sulfure de zinc mêlé de sulfure de plomb). L'enrichissement du minerai s'effectue généralement par flottation. Avant traitement métallurgique, on procède à un grillage pour amener les concentrés à l'état d'oxyde. Les deux procédés d'élaboration sont la voie sèche (voie thermique) et la voie humide par électrolyse (ou hydrométallurgie), aujourd'hui prépondérante.
L'extraction par voie thermique est fondée sur la réduction de l'oxyde de zinc par le carbone ou l'oxyde de carbone à haute température (environ 1 000 °C), le métal passant à l'état de vapeur, que l'on condense. Un raffinage par liquation au four ou/et par distillation fractionnée est ensuite nécessaire pour obtenir le métal pur. L'extraction par voie humide se fait par électrolyse d'une solution de sulfate de zinc obtenue par lixiviation, décantation et filtration ; elle donne un métal de grande pureté.
Le zinc est employé sous forme de revêtement pour la protection contre la corrosion atmosphérique (galvanisation, métallisation, zingage, etc.) et sous forme massive pour la protection de l'acier (anodes sacrificielles). Il entre enfin dans la composition de nombreux alliages : Zamak, Kayem, laitons, maillechorts, etc.
GÉOGRAPHIE
La production mondiale de minerai s'élève à 8 Mt (poids de métal contenu) contre 1,86 Mt en 1939. Elle est dominée par la Chine (1,4 Mt) devant l'Australie (1,2 Mt), le Canada (1 Mt), le Pérou (0,9), alors que l'apport américain, autrefois prédominant, a reculé (0,8 Mt). La géographie de la production de fonderie est différente, grâce à une implantation ancienne dans des pays pas ou peu producteurs de minerai comme la France, la Belgique ou l'Allemagne en Europe occidentale, le Japon.
MÉDECINE
Le zinc est un oligoélément indispensable à l'organisme, qui permet notamment l'activation d'un grand nombre d'enzymes, principalement celles qui sont impliquées dans la synthèse des protéines (A.R.N. polymérases en particulier).
Besoins et sources
Les apports quotidiens conseillés en zinc (Zn) sont de l'ordre de 6 à 12 milligrammes pour l'enfant, de 10 à 13 milligrammes pour l'adolescent, de 10 milligrammes pour la femme, de 12 milligrammes pour l'homme, de 14 milligrammes pour la femme enceinte et de 19 milligrammes pour la femme qui allaite. Les principales sources alimentaires de zinc sont les aliments riches en protéines d'origine animale (viande, poisson, produits laitiers, œufs) mais aussi les céréales complètes. L'absorption intestinale du zinc varie selon la composition du repas : de 30 % de la quantité de zinc ingérée (pour un repas riche en viande) à 20 % (pour un repas riche en végétaux et pauvre en viande) ; de plus, les céréales et les légumes secs gênent cette absorption.
Dosage
La zincémie (taux de zinc dans le sang), de dosage délicat, est fonction de l'apport alimentaire en zinc : les valeurs normales se situent entre 10 et 20 micromoles par litre.
Carence
Une carence en zinc peut être due à un apport alimentaire insuffisant, à une augmentation des besoins (croissance, grossesse), à différents états pathologiques (alcoolisme, diabète, infection) ou à un trouble héréditaire du métabolisme du zinc (acrodermatite entéropathique). Les symptômes de la carence varient selon sa gravité : retard de croissance, altérations de la peau et des muqueuses (dermite séborrhéique, inflammation de la commissure des lèvres, éruption semblable à de l'eczéma ou à du psoriasis), chute des cheveux, perte du goût, diminution de l'appétit, problèmes de cicatrisation, troubles de l'immunité et de la maturation sexuelle (atrophie des gonades [testicules, ovaires], diminution de la spermatogenèse) et, chez la femme enceinte, risque de malformations et d'hypotrophie fœtales.
Apport excessif
Une surcharge en zinc peut survenir en cas d'intoxication aiguë ou chronique d'origine industrielle (inhalation de vapeurs riches en oxyde de zinc), en cas de supplémentation excessive ou au cours de maladies héréditaires exceptionnelles (maladie de Pick, hyperzincémie familiale) ; elle risque de provoquer une carence en cuivre, ces deux éléments entrant en compétition, lors de leur absorption intestinale.
Utilisation thérapeutique
Le zinc est utilisé, par voie orale et injectable, dans la prévention et le traitement des carences correspondantes et par voie orale au cours du traitement de l'acné (gluconate de zinc). Il entre également dans la composition de certains médicaments (certaines insulines, par exemple).
PHARMACIE
Le sulfate de zinc, associé au sulfate de cuivre, constitue le principe actif de l'eau de Dalibour. L'oxyde de zinc est surtout utilisé à l'extérieur, comme topique isolant, en nature ou sous forme de pommades diverses. Le zinc, associé ou non à des protamines, constitue avec l'insuline des complexes qui confèrent à cette dernière une action « retard ».
BOTANIQUE
La carence en zinc provoque une diminution de taille, une modification de la disposition des feuilles (en rosette) et de leur coloration, et fait apparaître des malformations (maïs, arbres fruitiers).




