isomérie
Relation entre deux substances chimiques de même formule brute, mais dont l’arrangement des atomes diffère.
CHIMIE
L’isomérie est une notion fondamentale en chimie organique : à une formule brute donnée correspondent souvent plusieurs formules semi-développées ou développées ; les molécules correspondantes sont des isomères. On distingue l’isomérie plane, ou de constitution, et la stéréoisomérie (ou isomérie stérique) qui concerne la disposition des atomes dans l’espace.
1. Isomérie plane ou de constitution
On distingue l’isomérie de chaîne, celle de position et celle de fonction.
1.1. Isomérie de chaîne
Des isomères de chaîne ont des squelettes carbonés différents. Par exemple, le butane de formule brute C4H10 présente les deux isomères de chaîne suivants :
CH3―CH2―CH2―CH3 et
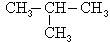 .
.
1.2. Isomérie de position
Des isomères de position ne diffèrent que par la position d’un groupement d’atomes dans la molécule. Par exemple, le 1-propanol et le 2-propanol sont des isomères de position :
CH3―CH2―CH2―OH et

Les isomères de chaîne et de position présentent les mêmes fonctions chimiques : ils ont donc les mêmes propriétés chimiques. Cependant, leurs propriétés physiques peuvent être très différentes.
1.3. Isomérie de fonction
Deux isomères de fonction présentent des fonctions chimiques distinctes ; ils n’appartiennent pas à la même classe de composés.
Par exemple, le méthoxy-éthane de formule CH3―CH2―O―CH3 et le 1-propanol de formule CH3―CH2―CH2―OH sont deux isomères de fonction.
Ils diffèrent à la fois par leurs propriétés chimiques et par leurs propriétés physiques.
La tautomérie est un cas particulier de l’isomérie de fonction : on dit qu’il y a une relation de tautomérie entre deux isomères de fonction qui se transforment réversiblement l’un en l’autre. Il existe alors un équilibre chimique entre les deux formes tautomères.
Exemple :

2. Stéréoisomérie
La plupart des molécules sont tridimensionnelles. Leur structure stérique, étudiée en stéréochimie, est la disposition relative de leurs atomes dans l’espace. Des isomères – de même constitution – sont des stéréoisomères lorsqu’ils ne diffèrent que par l’arrangement de leurs atomes dans l’espace. La stéréoisomérie est donc la relation entre deux stéréoisomères.
2.1. Énantiomérie et chiralité
Une molécule est dite chirale (prononcer « kiral ») si son image par rapport à un miroir ne lui est pas superposable (→ chiralité). Une molécule chirale ne possède ni centre ni plan de symétrie. Dans le cas contraire, on dit qu’elle est achirale.
À une substance chirale correspond toujours un isomère stérique, son énantiomère. Deux stéréoisomères de configuration qui sont les images l’un de l’autre par rapport à un miroir mais non superposables (même en effectuant une rotation de la molécule) seront appelés énantiomères. Par exemple, les deux molécules ci-dessous sont deux énantiomères de l’acide lactique :
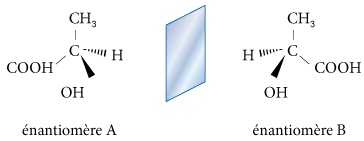
2.2. Activité optique ou pouvoir rotatoire
Deux énantiomères ont des propriétés chimiques ou physiques identiques tant que le réactif ou le phénomène (→ réaction chimique) mis en jeu possède la symétrie de réflexion (images en miroir). Il est en revanche aisé de mettre en évidence expérimentalement une différence de comportement en utilisant un réactif ou phénomène chiral. C’est ainsi que deux énantiomères dévient en sens inverse et d’un angle égal le plan d’une lumière polarisée plane ; on mesure alors le pouvoir rotatoire. C’est la raison pour laquelle on parle d’isomérie optique.
L’énantiomère qui fait tourner le plan de polarisation dans le sens des aiguilles d’une montre (angle positif) pour l’observateur qui reçoit le rayon est dit dextrogyre ; l’autre qui fait tourner le plan de polarisation du même angle mais dans le sens inverse (angle négatif) est dit lévrogyre. Ainsi, pour spécifier chaque énantiomère, on fait précéder le nom des composés des signes (+) ou (–).
Les réactions enzymatiques et les activités biologiques sont très souvent liées à la chiralité moléculaire. Par exemple :
• la (–)-méthadone est un fort analgésique tandis que son énantiomère (+) est pratiquement inactif ;
• le (–)-menthol a un goût naturellement frais, le (+)-menthol ne possède pas cette propriété.
La chiralité est très fréquente dans la nature et la synthèse d’un énantiomère pur, qui est la règle dans le milieu biologique, pose de réelles difficultés au laboratoire. C’est ainsi que les mélanges équimoléculaires d’énantiomères sont choses courantes. Ce sont des mélanges dits racémiques. Le pouvoir rotatoire d’un mélange racémique est nul par suite de la compensation des rotations de chacun des énantiomères.
2.3. Notion de prochiralité
Si une molécule chirale est obtenue à partir d’une molécule achirale en remplaçant un atome ou groupe de cette molécule par un autre atome ou groupe, la molécule est dite prochirale. En pratique, on parle d’un atome prochiral plutôt que d’une molécule prochirale.
2.4. Configuration des carbones asymétriques (configuration absolue)
Un carbone est dit asymétrique lorsqu’il est relié à quatre groupements de natures différentes. Les quatre liaisons chimiques d’un atome de carbone (tétravalent) forment un tétraèdre. Ainsi, un carbone asymétrique présente deux configurations possibles selon l’emplacement et le « poids » relatif des différents groupements autour de l’atome de carbone.
Pour distinguer les carbones asymétriques entre eux, on utilise une nomenclature spécifique basée sur leur configuration : la nomenclature en R/S de Cahn, Ingold et Prelog. Pour chaque carbone asymétrique, on ordonne les quatre substituants a, b, c et d par ordre de numéros atomiques décroissants des premiers atomes liés au carbone. On regarde alors le modèle du côté opposé au dernier groupe d et on note le sens dans lequel on tourne pour voir défiler les trois autres groupes dans l’ordre de classement : la configuration du carbone asymétrique est R (rectus, droit) si les groupes tournent dans le sens des aiguilles d’une montre et S (sinister, gauche) dans le sens inverse.
Exemple : la configuration du carbone asymétrique de l’analine est R.
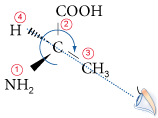
2.5. Diastéréoisomérie
Par définition, les diastéréoisomères sont des stéréoisomères de configuration qui ne sont pas énantiomères (ils ne sont pas images l’un de l’autre dans un miroir). Ils peuvent être chiraux ou achiraux.
Les diastéréoisomères n’ont pas les mêmes propriétés physico-chimiques, ce qui permet de les séparer facilement contrairement aux énantiomères.
Exemples :
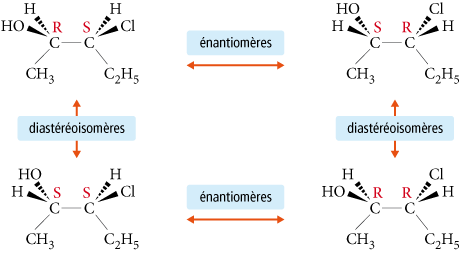
Les molécules contenant des liaisons multiples peuvent également être des diastéréoisomères. Exemple : l’acide maléique (ou acide butènedioïque) existe sous deux configurations :
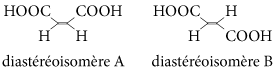
Les groupes carboxyles ne sont pas placés de la même façon dans les deux molécules. Pour distinguer ces deux molécules, on utilise une nomenclature qui dépend de la position relative des groupes d’atomes par rapport à la double liaison.
On attribue un « rang » aux atomes ou groupes d’atomes reliés à chaque carbone intervenant dans la double liaison selon la règle de Cahn, Inglod et Prelog. Ici, les groupes COOH sont au rang 1 et les atomes d’hydrogène au rang 2. Si deux groupes de rang 1 se trouvent du même côté de la double liaison (on dit « en position cis »), la molécule sera le stéréosisomère Z (de l’allemand zuzammen : ensemble) ; s’ils sont de chaque côté de la double liaison (on dit « en position trans »), la molécule sera le stéréosisomère E (de l’allemand entgegen : opposé).

2.6. Applications : les synthèses de molécules chirales
Il existe différentes méthodes permettant de synthétiser des molécules chirales, et donc de contrôler la chiralité (→ synthèse [chimie]). Cela est notamment utilisé dans la synthèse des médicaments qui, pour la plupart, sont formés de molécules chirales. Pour transmettre la chiralité, une méthode consiste à créer un carbone chiral, une autre à modifier la chiralité d’une molécule dans une réaction contrôlée, une troisième consiste à modifier une molécule chirale dans une réaction qui n’affectera pas son centre de chiralité.




