acide carboxylique
Acide organique possédant un ou plusieurs groupes carboxyles CO2H.
La formule générale des acides carboxyliques est R–COOH (ou R–CO2H), où R est un groupement alkyle (CnH2n+1 , n étant le nombre d’atomes de carbone dans la molécule). En chimie organique, les acides carboxyliques sont souvent simplement appelés acides acide.
1. Nomenclature des acides carboxyliques
1.1. Chaînes carbonées
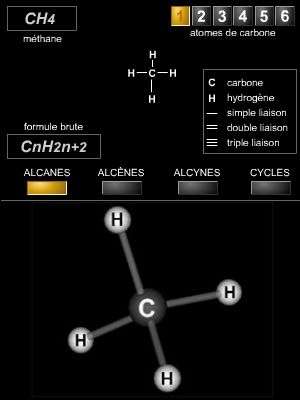
Selon la nomenclature officielle de l’IUPAC (International Union of Pure and Applied Chemistry), le nom d’un acide carboxylique s’obtient en ajoutant le suffixe -oïque (ou dioïque pour un diacide) au nom de l’hydrocarbure correspondant (en remplacement de la terminaison e) et en le faisant précéder du terme acide. Pour les acides carboxyliques, il n’est pas nécessaire d'attribuer un indice de position à la fonction carboxyle, car elle est toujours portée par un carbone en bout de chaîne.
Pour exemples, on peut citer l’acide éthanoïque (CH3–COOH), dérivé de l'éthane (CH3–CH3), ou l’acide butanedioïque (HOOC–CH2–CH2–COOH), dérivé du butane (CH3–CH2–CH2–CH3).
1.2. Cycles
Les acides carboxyliques cycliques sont nommés en faisant précéder le mot acide du nom de l’hydrocarbure suivi du suffixe carboxylique (par exemple, l’acide cyclopentanecarboxylique de formule C5H9–COOH).
1.3. Noms particuliers

On notera toutefois que certains acides sont désignés par des noms. Parmi les plus courants, on trouve :
• l’acide formique (ou méthanoïque) ;
• l’acide acétique (ou éthanoïque) qui sous forme dilué est plus connu sous le nom de vinaigre ;
• l’acide propionique (ou propanoïque) ;
• l’acide acrylique (ou propènoïque) ;
• l’acide oxalique (ou éthanedioïque) ;
• l’acide malonique (ou propanedioïque).
2. Propriétés physico-chimiques des acides carboxyliques
À température ordinaire, les acides carboxyliques à chaîne carbonée linéaire sont liquides ou solides ; leur point de fusion ne dépasse pas les 100 °C (par exemple, l’acide stéarique qui compose les bougies, fond vers 70 °C).
Ils ont des points d’ébullition très élevés, supérieurs à ceux des alcools, car ils ont tendance à former des dimères cycliques par liaisons hydrogène entre les groupes OH et C=O.
Par ailleurs, leur solubilité dans l’eau diminue avec la longueur de leur chaîne : les quatre premiers acides de la nomenclature sont totalement solubles dans l’eau ; puis la solubilité diminue et devient nulle à partir de l’acide nonanoïque (C9H18O2).
3. Réactivité des acides carboxyliques
Comme pour chaque famille de composés organiques, la réactivité d’un composé dépend essentiellement de celle de son groupe fonctionnel. Le groupe fonctionnel des acides carboxyliques est composé du groupe hydroxyle OH caractéristique des alcools et du groupe carbonyle C=O caractéristique des aldéhydes et des cétones. Toutefois, la réactivité des acides ne se résume pas simplement à la somme de celles de ces deux groupes. En fait, les deux groupes OH et C=O ne sont pas indépendants l’un de l’autre : ils forment une structure mésomère engageant les doublets non liants des atomes d’oxygène et de la double liaison C=O.
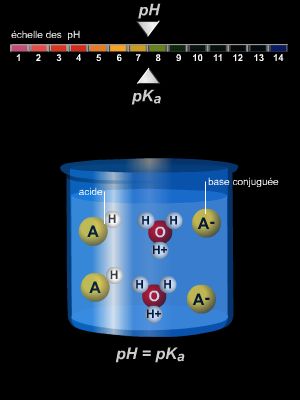
L’ion carboxylate RCOO–, base conjuguée des acides (→ acido-alcalinité), forme ainsi une structure très stable, à l’origine de l’acidité moyenne (pKa de l’ordre de 5, → pH) des acides carboxyliques. Ceux-ci forment alors de nombreux sels, en raison de l’hydrogène du groupe OH qui est facilement attaqué par les bases.
De même, en raison de leur stabilisation par résonance, ils subissent avec difficulté des réactions de substitution tendant à remplacer le groupe OH par un groupe OR (estérification) ou NR2 (amidification).
La réduction, bien que très difficile, peut mener à l’alcool primaire (RCO2H → RCH2OH).
Par ailleurs, la perte du groupe carboxyle CO2, ou décarboxylation, menant à la formation d’un hydrocarbure, n’est pas aisée mais peut toutefois être réalisée à température plus ou moins élevée selon le type d’acide.
Les acides carboxyliques forment aisément des dimères, ce qui leur confère des points d’ébullition et de fusion élevés.
4. État naturel
Les acides carboxyliques sont très répandus dans la nature. En effet, ceux à chaîne linéaire plus ou moins longue forment la famille des acides gras, principaux constituants des lipides. Parmi les acides gras naturels faisant partie de notre quotidien, on peut citer l’acide butanoïque (ou butyrique) présent dans le beurre ou l’acide linoléique des huiles végétales.
D’autres types acides interviennent également dans notre vie quotidienne, en particulier les hydroxyacides tels que l’acide lactique présent dans le lait ou l’acide citrique des citrons. Enfin, on peut encore citer les acides aminés qui interviennent dans la constitution des protéines.
5. Préparation des acides carboxyliques
Il existe diverses façons de préparer les acides carboxyliques, les plus connues étant la saponification d’un ester :
R–COOR' + NaOH → R–COONa + R'–OH
R–COONa + HCl → R–COOH + NaCl
et l’hydrolyse d’un ester :
R–COOR' + H2O ⇆ R–COOH + R'–OH
Parmi les autres méthodes d’obtention des acides carboxyliques, on peut citer l’oxydation des alcènes ou l’oxydation des aldéhydes et cétones, la synthèse organomagnésienne, etc.
Pour en savoir plus, voir l'article synthèse [chimie]
Utilisation des acides carboxyliques
L’un des acides carboxyliques le plus utilisé est aussi le plus connu puisqu’il s’agit de l’acide acétique (ou éthanoïque), qui se forme lors de la transformation du vin en vinaigre (→ fermentation). Il est utilisé de manière industrielle dans la préparation de divers acétates entrant dans la composition de solvants, de peintures, de textiles, etc.
D’autres acides ont des applications industrielles, notamment l’acide acrylique pour la fabrication d’esters polymérisables, ou l’acide adipique pour la synthèse du Nylon.