synthèse

Préparation d’un composé chimique à partir de corps simples.
CHIMIE
La synthèse organique (→ chimie organique) peut se définir comme l’assemblage de différents groupes d’atomes, appelés synthons. Cet assemblage est réalisé par une série de réactions chimiques dont le but est de présenter des qualités optimales de régiospécificité (réactions ayant lieu sur des sites spécifiques des molécules) et de stéréospécificité (réactions privilégiant un arrangement spatial particulier des molécules). Pour atteindre ce but, une connaissance parfaite de la théorie des réactions chimiques est nécessaire.
1. Bases théoriques de la synthèse organique
La synthèse organique dispose de théories capables de fournir une aide efficace dans la prédiction de nouvelles réactions et dans l’amélioration de leurs rendements. Parmi celles-ci, la théorie électronique de la chimie organique constitue une aide primordiale permettant de rationaliser et de comprendre les réactions chimiques. La théorie des orbitales moléculaires fournit les moyens de calculer la plupart des propriétés physiques et de prédire les sites d’attaque dans une molécule organique. Elle permet également de comprendre et de systématiser certaines règles de formation des configurations.
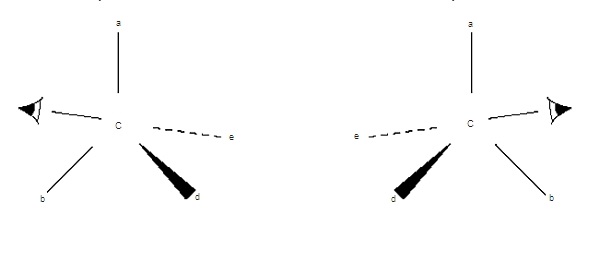
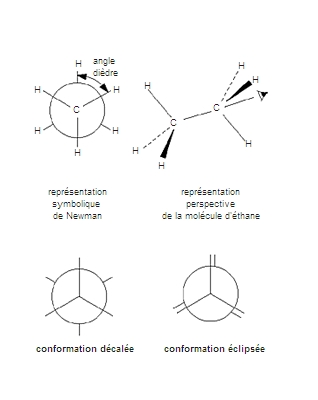
Cependant, ces théories et ces calculs ne résolvent pas tous les problèmes de la réactivité chimique des molécules organiques. En effet, une fois la constitution et la configuration de la molécule mises au point, le chimiste doit encore réfléchir sur les conformations. En général, les molécules organiques ont des conformations privilégiées que l’on peut prédire et qui conditionnent la stéréosélectivité dans la formation des configurations de la molécule (en fonction de l’arrangement spatial préférentiel des molécules de départ, la réaction privilégie la formation d’un type particulier de molécules). À ce stade, on peut rationaliser les idées qualitatives de l’analyse conformationnelle par des calculs empiriques fondés sur la méthode de calcul des champs de force (c’est-à-dire des interactions entre les molécules) et aboutir à une véritable modélisation. Quand les molécules étudiées sont classiques, de tels calculs peuvent se révéler d’une exactitude remarquable.
2. Méthodologie des synthèses organiques
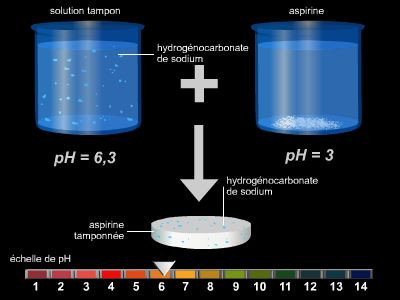
La synthèse de l’urée par Friedrich Wöhler en 1828 à partir de cyanate de plomb, d’eau et d’ammoniac, montre qu’il est possible de créer artificiellement un composé organique à partir de composés inorganiques plus simples. Cette première synthèse ouvre ainsi la voie à la production (rapidement industrielle) d’une quantité phénoménale de nouvelles molécules plus ou moins complexes (acide acétique, saccharine, aspirine, etc.) en partant d’unités simples.
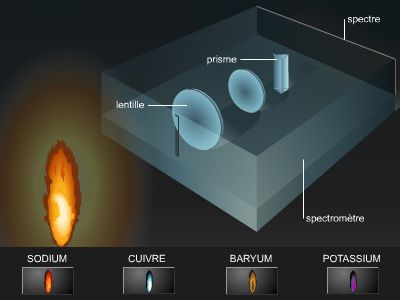
La méthodologie de synthèse a très rapidement évolué au cours du xxe siècle, grâce aux progrès réalisés en analyse chimique (techniques spectroscopiques notamment) permettant d’avoir accès aux structures et aux propriétés chimiques des différents réactifs et produits de synthèse. Et cette évolution s’est encore accentuée depuis les années 1980. Les méthodes de synthèse organique font désormais appel à des réactifs séléniés, des organoboranes, des organosiliciés, des sulfones ou bien des sulfoxydes. De plus, l’utilisation de nouveaux solvants (DMSO, DMF, HMPT, etc.) a bouleversé le déroulement de certaines réactions. Par ailleurs, une meilleure connaissance des mécanismes réactionnels permet l’utilisation synthétique des carbanions, des carbocations, des radicaux libres, d’espèces mettant en œuvre des métaux de transition (Cu, Ni, Pd, Fe, etc.).
L’utilisation des micelles et de la chimie aux interfaces fait aujourd’hui de la catalyse par transfert de phase (entre une phase aqueuse et une phase organique non miscible) une méthode de synthèse classique.
Enfin, dans le cadre de la chimie biomimétique, il faut mentionner le vaste domaine mis en œuvre par l’utilisation d’enzymes à des fins synthétiques, qui peut aller jusqu’à l’utilisation d’enzymes immobilisées sur polymères.
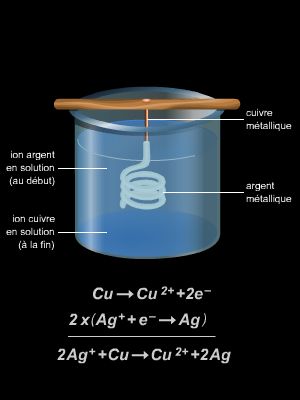
Les recherches en synthèse organique s’orientent désormais sur le développement de réactions hautement stéréosélectives (réactions privilégiant la formation d’un seul type de molécules) et sur leur application dans des synthèses complexes. Ainsi, l’alkylation stéréosélective des dérivés carbonylés telle que l’aldolisation stéréosélectivement controlée, mais aussi les oxydations, les époxydations, les réductions stéréosélectives illustrent ce propos. De même, de nombreux travaux concernent la formation stéréosélective de doubles liaisons carbone-carbone, les applications modernes de la réaction de Diels-Alder et des réactions de cycloadditions.
3. Classification des réactions organiques
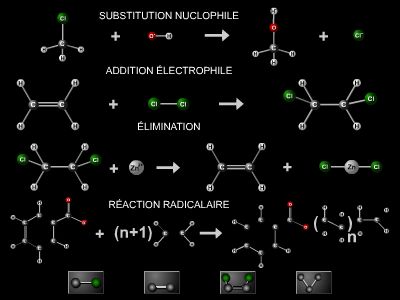
Les réactions de la chimie organique peuvent donner lieu à plusieurs modes de classification, selon les critères de sélection envisagés. Nous retiendrons les réactions ne faisant intervenir ni oxydants ni réducteurs, qui sont appelées réactions isohypsiques, dans lesquelles le degré d’oxydation est conservé, et les réactions de réduction et d’oxydation dans lesquelles le degré d’oxydation est respectivement diminué ou augmenté.
On peut distinguer dans chaque groupe plusieurs types de réactions.
3.1. Les réactions de substitution
Les réactions de substitution sont des réactions dans lesquelles un atome ou un groupe d’atomes se fixe sur la molécule tandis qu’un autre en est écarté.
Dans le groupe des réactions isohypsiques, de telles substitutions ont lieu avec :
• deux atomes électronégatifs : CH3–Cl → CH3–OH
• deux atomes électropositifs : C6H5–CH3 → C6H5–CH2Na
Si un hétéroatome est remplacé par un atome de carbone, il y a condensation carbonée :
CH3–Cl + CH2(COOC2H5)2 → CH3–CH(COOC2H5)2
3.2. Les réactions d’addition et d’élimination
Les réactions d’addition comportent la fixation d’un atome à chacune des extrémités d’une liaison multiple. Les additions isohypsiques concernent un atome électronégatif et un atome électropositif, généralement l’hydrogène.
Il y a échange fonctionnel si l’atome électronégatif est un hétéroatome, et condensation carbonée si cet atome est un atome de carbone :
C6H5–CH2–CH=CH2 + HBr → C6H5–CH2–CHBr–CH3
CH3OOC–CH=CH2 + C6H5–CH2–CO–CH3 → CH3OOC–CH2–CH2CH(C6H5)CO–CH3
Les réactions d’élimination qui se produisent dans le groupe des réactions isohypsiques concernent la formation d’une liaison multiple par le départ d’un atome électronégatif et d’un atome électropositif, très généralement l’hydrogène :
CH3–CH2OH → CH2=CH2
3.3. Les réactions de transposition (ou réarrangement)
Dans les réactions de transposition (→ réarrangement), il y a migration d’un atome de carbone, d’un hétéroatome ou d’un groupe d’atomes d’un site de la molécule vers un autre site, avec successivement rupture et création d’une liaison carbone-carbone ou carbone-hétéroatome. On observe ainsi des migrations de fonctions, d’insaturations ou de groupes carbonés entre atomes de carbone, comme par exemple dans le réarrangement de Beckmann :
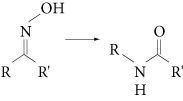
3.4. Les réactions de dégradation
Dans les réactions de dégradation, il y a rupture d’une liaison carbone-carbone et formation d’une liaison avec un hétéroatome sur chacun des deux atomes de carbone ainsi séparés. Si la dégradation est isohypsique, les liaisons formées sont des liaisons carbone-oxygène. Par exemple :
C3H7–CH=CH–CO2H → CO2 + C3H7–CH=CH2
3.5. Les réactions de réduction
Il existe différents types de réactions de réductions, qui entraînent une diminution du degré d’oxydation de la molécule :
• réactions de substitution réductrice où un hétéroatome électronégatif est remplacé par un atome d’hydrogène ou de métal :
C6H5–CH2–Cl + H2 → C6H5–CH3 + HCl
• réactions d’addition réductrice où deux atomes d’hydrogène ou de métal sont fixés aux deux extrémités d’une liaison multiple :
RCH=CHR' + H2 → RCH2–CH2R'
• réactions d’élimination réductrice où une liaison multiple est créée par le départ de deux atomes électronégatifs :
Br–CH2–CH2–Br → CH2=CH2 + Br2
• réactions de duplication réductrice qui entraîne la formation d’une liaison carbone-carbone entre deux molécules portant chacune un hétéroatome électronégatif :
2 CH2=CH–CH2Br → CH2=CH–CH2–CH2–CH=CH2 + Br2
3.6. Les réactions d’oxydation
Les réactions d’oxydation, qui entraînent une augmentation du degré d’oxydation, comprennent :
• les substitutions oxydantes qui correspondent au remplacement d’un atome d’hydrogène ou de métal par un hétéroatome électronégatif :
C6H5–CH3 + HCl → C6H5–CH2Cl + H2
• les additions oxydantes dans lesquelles deux atomes électronégatifs sont fixés sur une liaison multiple :
CH2=CH2 + Cl2 → Cl–CH2–CH2–Cl
• les éliminations oxydantes, dans lesquelles une liaison multiple est créée par le départ de deux atomes d’hydrogène ou de métal :
C6H5–CH2–OH → C6H5–CH=O + H2
• les duplications oxydantes qui entraînent la formation d’une liaison carbone-carbone entre deux molécules portant chacune un hétéroatome électropositif (hydrogène ou métal) :
2 (CH3)3C–MgCl → (CH3)3C–C(CH3)3 + 2MgCl
• les dégradations oxydantes où deux hétéroatomes électronégatifs sont fixés sur les deux atomes de carbone dont la liaison est rompue :
CH3–CH=CH2 + O2 → CH3–CH=O + O=CH2
4. Mécanismes des réactions
Il est très important de connaître les différents types de mécanismes réactionnels à l’origine des réactions de chimie organique. Celles-ci peuvent débuter :
• par un clivage hétérolytique, c’est-à-dire par la rupture d’une liaison dont le doublet électronique reste entièrement sur l’un des fragments. De telles réactions, dites ioniques, sont favorisées par les solvants polaires et sont catalysées par les acides et les bases ;
• par un clivage homolytique, où les électrons d’un doublet sont séparés et emportés chacun par un fragment. De telles réactions, dites radicalaires, sont favorisées par les solvants neutres et sont provoquées par chauffage ou par irradiation.
Les réactions peuvent également se dérouler selon une réorganisation des orbitales, sans apparition d’ions ou de radicaux. Ces réactions, dites électrocycliques, sont également provoquées par chauffage ou irradiation.
Les réactions ioniques sont de très loin les réactions les plus importantes et peuvent être considérées comme le résultat de la combinaison d’attaques et de départs. On distingue quatre éléments fondamentaux :
• le départ électrofuge (DE), dans lequel l’élément partant abandonne son doublet de liaison ;
• le départ nucléofuge (DN), dans lequel l’élément partant emporte son doublet de liaison ;
• l’attaque nucléophile (AN), dans laquelle l’élément entrant apporte son doublet de liaison à l’atome attaqué ;
• l’attaque électrophile (AE), dans laquelle l’élément entrant se fixe sur un doublet de l’atome attaqué.
5. Stratégie en synthèse organique

La recherche du schéma (ou plan) de synthèse permettant l’élaboration du squelette d’une molécule doit se faire par une voie anti-synthétique (rétrosynthèse), c’est-à-dire en fractionnant la molécule cible en différents morceaux, jusqu’à obtenir des synthons (éléments simples) commerciaux ou facilement accessibles. Les problèmes de chimiosélectivité, de régiosélectivité, ainsi que ceux liés à la stéréochimie (réactions stéréospécifiques ou stéréosélectives) sont à prendre en compte à ce stade.
À la suite du travail de pionnier du chimiste américain Elias James Corey et de diverses approches théoriques, plusieurs systèmes d’élaboration de schémas de synthèse organique assistée par ordinateur ont vu le jour. Cela suppose au préalable la constitution d’un fichier documentaire permettant de connaître les exemples se rapprochant le plus possible des réactions proposées. Pour mettre un tel fichier en mémoire, il faut introduire totalement ou partiellement la structure des molécules qui réagissent, du (ou des) produit(s) de la réaction et éventuellement des catalyseurs et solvants. Mais avant toute chose, il est nécessaire d’avoir un système de classement logique et cohérent étant donné le grand nombre d’exemples fournis et leur diversité.
6. Applications et enjeux économiques de la synthèse organique
Les produits de la synthèse organique constituent l’immense majorité des produits de notre environnement quotidien. En 2010, on compte plus de 10 millions de composés organiques obtenus par voie de synthèse. Parmi ces composés produits à l’échelle industrielle à partir de diverses transformations du pétrole, on peut citer les détergents, les solvants, les matières plastiques, les pesticides, les médicaments, etc.