radioactivité

Propriété des nucléides instables de perdre spontanément de leur masse en émettant des particules ou des rayonnements électromagnétiques.

La découverte, presque par hasard, de la radioactivité par H. Becquerel en 1896 a entraîné une révolution dans la connaissance de la nature de la matière. Elle a montré que les noyaux atomiques ne sont pas tous stables : certains d'entre eux, dits « radioactifs », éjectent de minuscules projectiles sous forme de rayons pénétrants ; de plus, une telle émission change leur nature. On en a déduit que les éléments ne sont pas vraiment « élémentaires » et que les atomes sont composés d'« éléments » plus petits.
Nature et transformations des noyaux atomiques
Les radioactivités naturelles

Suite à la découverte du radium par P. et M. Curie en 1898, il est vite apparu qu'il existe trois sortes de radioactivité. À chacune d'elles correspond une transformation différente des noyaux. L'étude de la radioactivité et celle des rayonnements ont aussi largement contribué à comprendre la structure des noyaux. Ceux-ci ne sont pas des objets simples : ils sont composés de deux sortes de particules, les protons et les neutrons. La façon dont ceux-ci se combinent a conduit à la notion d'isotope, à l'étude des conditions de stabilité des noyaux et à la reconnaissance de deux sortes de forces s'y exerçant : l'interaction forte et l'interaction faible.
Les radioactivités artificielles
En bombardant des noyaux à l'aide de rayons α, I. et J. F. Joliot-Curie ont provoqué la formation de noyaux radioactifs nouveaux. C'est un moyen pour produire un grand nombre d'isotopes radioactifs. De manière analogue, on sait aujourd'hui projeter sur d'autres atomes des ions lourds accélérés à haute énergie. Il devient possible d'obtenir des combinaisons nucléaires nouvelles, le plus souvent très instables, dont certaines sont très différentes de tout ce qu'on peut observer dans les corps radioactifs naturels ou à l'aide de collisions par des particules. On a pu ainsi produire des formes de radioactivité atypiques, comme l'émission de noyaux de carbone.
Les principaux types de radioactivité
Les radioactivités se distinguent par la nature du rayonnement émis et par les modifications que cela induit dans le noyau émetteur. Un noyau est caractérisé par sa masse atomique A, égale au nombre de nucléons qu'il contient, et par son numéro atomique Z, égal au nombre de ses protons. La différence A − Z représente donc le nombre de ses neutrons ; pour le plutonium 244, par exemple, A = 244, Z = 94 ; il contient donc 150 neutrons.
Les transformations radioactives sont plus ou moins rapides. On appelle « période » ou « demi-vie » le temps nécessaire pour que la moitié des noyaux de l'élément considéré se soit désintégrée. Ce temps, qui semble indépendant de toute action extérieure, varie considérablement d'un noyau à un autre (de 10−12 s à 1017 années).
La radioactivité alpha
Les rayons α sont constitués de particules de masse égale à 4 fois la masse du proton et dont la charge électrique est le double de celle du proton : il s'agit de noyaux d'hélium. Toutes les particules issues d'une même espèce de noyaux radioactifs (en général de très gros noyaux) sont émises avec la même énergie. Cette émission provoque un changement de nature du noyau : le numéro atomique diminue de deux unités, la masse atomique, de quatre. Ainsi, lors de la désintégration α du plutonium 244, celui-ci se transforme en uranium 240, avec une demi-vie de 80 millions d'années :
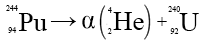 .
.
La radioactivité bêta
Dans la radioactivité β, le noyau émet un électron au cours de la transformation d'un neutron en proton. La charge électrique et le numéro atomique du noyau augmentent d'une unité, mais la masse atomique demeure sensiblement inchangée, car la masse d'un électron est très faible. Il existe aussi une radioactivité β+ (bêta plus) où un positron est émis, ce qui fait décroître d'une unité le numéro atomique du noyau (par transformation d'un proton en neutron). Pour une désintégration β donnée, tous les électrons émis n'ont pas la même énergie. Celle-ci est répartie selon un spectre d'énergie, ce qui a suggéré à W. Pauli et E. Fermi qu'une autre particule, un neutrino ν (ou, plus exactement, un antineutrino
 ), est émise en même temps que l'électron. Cette hypothèse a permis l'établissement de la théorie de l'interaction faible, qui régit la désintégration β. Celle-ci résulte donc de la désintégration de neutrons du noyau en protons, électrons et antineutrinos. Ainsi, lors de la désintégration de l'uranium 240 en neptunium (Np), seul le numéro atomique est affecté :
), est émise en même temps que l'électron. Cette hypothèse a permis l'établissement de la théorie de l'interaction faible, qui régit la désintégration β. Celle-ci résulte donc de la désintégration de neutrons du noyau en protons, électrons et antineutrinos. Ainsi, lors de la désintégration de l'uranium 240 en neptunium (Np), seul le numéro atomique est affecté :
 .
.
La radioactivité gamma
Dans la radioactivité γ, le noyau émet un photon de haute énergie. La nature chimique de l'atome n'est pas modifiée : le noyau passe d'un état excité à un état dit « fondamental ». En général, le noyau excité a été, au préalable, produit par une désintégration α ou β, ou encore par une réaction nucléaire.
Les familles radioactives
Dans la nature ou dans les produits de réactions nucléaires, on rencontre plusieurs familles radioactives : un noyau lourd, en se désintégrant, produit un noyau lui-même radioactif qui en engendre un troisième, et ainsi de suite jusqu'à un noyau stable qui constitue le produit final de la série. Les noyaux ayant des demi-vies bien déterminées, la connaissance de ces familles fournit un outil de datation géochimique.
L'utilisation de la radioactivité
La radioactivité connaît de nombreuses applications scientifiques et techniques. En géochimie isotopique, par exemple, elle permet de dater des roches, par la mesure de l'abondance respective de couples « père-fils », ou des échantillons contenant de la matière organique récente, par la technique du carbone 14 (datation).
Mais la radioactivité présente aussi des dangers : elle peut détruire les molécules biologiques, entraînant chez les êtres vivants des conséquences néfastes voire fatales (anémies, cancers…) ou bénéfiques (traitement des cancers par cobaltothérapie ou curiethérapie, diagnostics). Les normes d'utilisation des corps radioactifs sont draconiennes et la plupart des pays se sont dotés d'un système de surveillance.
Aspects médicaux
Mesure de la radioactivité
L'activité d'une source de rayonnement est mesurée en becquerels (Bq). Cette unité, valable à l'échelle atomique (elle correspond à une désintégration par seconde), n'est pas adaptée à l'évaluation d'un risque pour l'homme. La quantité de rayonnements reçue par un organisme (dose absorbée) se mesure en grays (Gy). Mais l'effet de ces rayonnements sur un organisme dépend aussi de leurs caractéristiques : la notion d'équivalent de dose, mesurée en sieverts (Sv), permet à la fois de prendre en compte ces données quantitatives et qualitatives. Le gray et le sievert ont remplacé des unités plus anciennes comme le rad (100 rads = 1 gray) et le rem (100 rems = 1 sievert).
Les normes de protection contre les rayonnements ont pour but de limiter leurs risques et de les maintenir à un taux comparable à celui que comporte toute activité humaine. Elles doivent tenir compte du niveau de radioactivité naturelle de l'environnement. Ainsi, en France, le rayonnement cosmique (venant du ciel) et tellurique (venant du sol) correspond à une dose de 2,4 millisieverts par an. À titre d'exemple, l'accident de Tchernobyl d'avril 1986 a augmenté cette dose annuelle de 0,07 millisievert pour la population française (source O.N.U.), ce qui est inférieur à la dose reçue lors d'un cliché radiologique. Les directives Euratom du Conseil de l'Union européenne fixent la dose annuelle admissible pour le public à 1 millisievert pour les irradiations d'origine non naturelle (industries nucléaires, hors domaine médical) et à 20 millisieverts pour le personnel exposé dans un cadre professionnel.
Effets des rayonnements
Du fait de leur énergie, les rayonnements radioactifs sont susceptibles d'exercer une action néfaste sur l'organisme. Les rayons alpha et bêta sont peu pénétrants et ne sont dangereux que s'ils sont introduits, par exemple, par ingestion de produits alimentaires contaminés. Les rayons gamma, en revanche, pénètrent profondément et peuvent traverser les organes (irradiation).
Les effets des rayonnements sont de deux types : ceux qui affectent directement l'être vivant et ceux qui atteignent sa descendance. Tous ces effets varient selon la dose reçue, la durée de l'exposition et l'étendue de la région exposée au rayonnement. Les effets de doses importantes sont bien connus quand celles-ci sont reçues en une seule fois par le corps entier. À l'inverse, l'effet de petites doses est plus difficile à évaluer.
Les effets précoces surviennent dans les heures, les jours ou les semaines qui suivent l'exposition à de fortes doses. À partir d'une dose de 0,2 sievert, les premières atteintes des rayonnements portent sur les cellules sanguines, surtout les globules blancs (infections) et les plaquettes (hémorragies). De 1 à 2 sieverts, on observe une radiodermite (rougeur de la peau). De 3 à 5 sieverts apparaissent des troubles digestifs (nausées, vomissements). Pour des doses plus importantes viennent s'ajouter des brûlures étendues et des troubles nerveux (paralysies).
Les effets tardifs ne sont décelables que pour des doses au moins égales à 1 sievert et après un délai moyen de 4 ans pour les leucémies, de 10 ans pour les autres cancers. Si le risque de développer un cancer est accru, la survenue de celui-ci n'est pas inéluctable. Pour des doses plus faibles, comprises entre 0,1 et 1 sievert, les cancers provoqués par des rayonnements sont plus exceptionnels, survenant surtout chez des enfants dont la mère a été irradiée pendant la grossesse. L'autre conséquence de l'irradiation d'un fœtus est le risque de survenue d'une malformation. L'effet de doses inférieures à 0,1 sievert ne s'est pas révélé significatif, comparé à la fréquence naturelle des malformations chez l'homme. Des irradiations plus importantes peuvent amener à proposer une interruption de grossesse, et cela d'autant plus que la grossesse en est à son début. Un autre effet tardif des rayonnements est la survenue d'une cataracte (opacification du cristallin de l'œil) pour des doses locales supérieures à 1 sievert.
L'uranium appauvri, présent dans de nombreux produits chimiques et dans certains obus, est composé de l'isotope 238, le moins radioactif des 3 isotopes qui composent l'uranium naturel. Il pourrait s'accumuler dans les reins. Utilisé pendant le conflit du Kosovo (1999), il a été accusé d'être responsable de l'apparition de cancers ou de leucémies, ce qui n'est pas démontré.
Les effets sur la descendance ont été décrits chez certains animaux (mutations) ; en revanche, aucune modification transmissible des gènes n'a été observée dans la descendance des populations irradiées d'Hiroshima ou de Nagasaki.
Protection contre les rayonnements
Quatre grands principes doivent être observés dans la protection contre la radioactivité : s'éloigner autant que possible de la source radioactive ; réduire le temps de séjour à proximité ; utiliser des écrans de protection (en plomb ou en béton contre les rayonnements gamma) ; s'efforcer d'éviter toute absorption accidentelle. L'utilisation de sources radioactives fait l'objet de mesures légales et réglementaires très strictes.
Pour en savoir plus, voir l'article irradiation.





