potentiel thermodynamique
Nom donné à certaines fonctions d’état d’un système thermodynamique, qui peuvent jouer, dans des conditions définies, un rôle analogue à celui du potentiel de pesanteur d’un système mécanique.
Considérons d’abord un système purement mécanique, corps de poids mg en mouvement. Le théorème des forces vives s’écrit dEc = dW, dEc étant la variation d’énergie cinétique du corps, et dW le travail des forces appliquées, travail reçu par le corps dans le même temps. Si, dans ce travail, on explicite celui de la pesanteur, on écrit dEc = – mgdz + dw, l’axe des z vertical étant orienté vers le haut ; dw est le travail des forces appliquées (électriques, etc.) autres que la pesanteur. Si l’on pose Ep = mgz, dite énergie potentielle de pesanteur, on écrit dEc + dEp = dw ; et, si l’on envisage en particulier un changement pour lequel Ec = 0 au début et à la fin, on aura pour ce changement  ,
,  étant le travail mécanique fourni par le corps (opposé au travail reçu), exception faite du travail de la pesanteur ; dans les conditions indiquées, la diminution d’énergie potentielle de pesanteur mesure le travail fourni par le corps.
étant le travail mécanique fourni par le corps (opposé au travail reçu), exception faite du travail de la pesanteur ; dans les conditions indiquées, la diminution d’énergie potentielle de pesanteur mesure le travail fourni par le corps.
Envisageons maintenant le cas où la seule force agissante est la pesanteur (pendule pesant par exemple). On a dEc + dEp = 0 ; d’où Ec + Ep = Cte ; si l’on suppose en particulier le corps immobile dans une position où Ep a sa valeur minimale compatible avec les liaisons, tout mouvement ultérieur spontané est impossible, car dEc, nécessairement positif, entraînerait dEp < 0, ce qui est contraire à l’hypothèse faite ; l’équilibre d’un tel corps correspond donc au minimum de l’énergie potentielle de pesanteur. Cette fonction Ep de la position du corps possède donc en particulier les deux propriétés vues plus haut ; on dit qu’elle est pour le corps un potentiel mécanique de pesanteur.
Un système réel n’est jamais purement mécanique, car ses transformations mettent en jeu, en dehors des échanges précédents, des échanges de chaleur ; c’est un système thermodynamique. Ses transformations, réversibles ou non, obéissent au premier principe de la thermodynamique, ce que l’on peut traduire par l’égalité dU = dQ + dW : l’accroissement de l’énergie interne (dU) du système est égal à la somme de la chaleur reçue (dQ) et du travail reçu (dW) par le système. Si, comme plus haut, on fait intervenir le travail 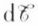 fourni par le système, on écrit
fourni par le système, on écrit 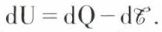
Dans le cas d’une transformation réversible, on peut écrire dQ = T.dS, T étant la température du système, et dS l’accroissement de son entropie ; on a donc  si l’on considère dès lors la fonction F = U – T.S, dite énergie libre du système, et si T est supposé constant au cours de la transformation, on peut écrire
si l’on considère dès lors la fonction F = U – T.S, dite énergie libre du système, et si T est supposé constant au cours de la transformation, on peut écrire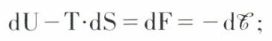
on voit que la fonction d’état F possède, pour les transformations réversibles, une propriété analogue au potentiel mécanique : sa diminution mesure le travail fourni par le système. Si, maintenant, on explicite le travail des forces de pression, on peut écrire  si donc on se place dans le cas particulier où dw = 0 et où le volume est maintenu constant (p · dv = 0), on a, pour toute transformation réversible isochore et isotherme dF = 0, c’est-à-dire F = Cte.
si donc on se place dans le cas particulier où dw = 0 et où le volume est maintenu constant (p · dv = 0), on a, pour toute transformation réversible isochore et isotherme dF = 0, c’est-à-dire F = Cte.
Dans le cas d’une transformation réelle, donc entachée d’irréversibilité, une certaine entropie δSirr > 0 est créée dans le système, et l’on a cette fois T · dS = dQ + T · δSirr ; d’où, puisque T · δSirr > 0, 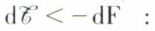 le travail fourni par le système est inférieur à la diminution de l’énergie libre, et c’est dans le cas d’une transformation réversible que l’on peut recueillir le travail le plus grand.
le travail fourni par le système est inférieur à la diminution de l’énergie libre, et c’est dans le cas d’une transformation réversible que l’on peut recueillir le travail le plus grand.
Dans le cas particulier d’une transformation réelle isotherme et isochore et où le travail fourni est nul, on a donc dF < 0 ; l’énergie libre diminue ; si l’état du système est tel que l’énergie libre ne puisse plus diminuer, c’est-à-dire ait sa valeur minimale compatible avec les diverses liaisons du système, alors aucune transformation réelle isotherme et isochore n’est possible dans le système à partir de cet état, lequel est donc un état d’équilibre : c’est cette propriété qui fait considérer la fonction F = U – T · S comme le potentiel thermodynamique à v et T constants.
Considérons maintenant le cas, très important en pratique, des transformations à pression et à température constantes : pour des transformations réversibles, on a vu que l’on avait dU = T · dS – p · dv + dw, avec les notations déjà indiquées ; si, dès lors, on considère la fonction délai G = U + p · v – T · S, dite enthalpie libre du système, on peut écrire, puisque p et T sont constants,
 désignant le travail fourni par le système, à l’exclusion de celui des forces de pression ; ainsi, pour ces transformations réversibles, la diminution de l’enthalpie libre mesure le travail fourni, avec la réserve faite.
désignant le travail fourni par le système, à l’exclusion de celui des forces de pression ; ainsi, pour ces transformations réversibles, la diminution de l’enthalpie libre mesure le travail fourni, avec la réserve faite.
Dans le cas des transformations réelles à la fois isothermes et isobares, on aura, par un raisonnement semblable à celui qui a été fait plus haut,  là encore, le travail maximal est obtenu lors des transformations réversibles.
là encore, le travail maximal est obtenu lors des transformations réversibles.
Si l’on suppose une transformation réelle à p et T constants et où  soit nul, on voit que G doit nécessairement diminuer au cours de cette transformation.
soit nul, on voit que G doit nécessairement diminuer au cours de cette transformation.
Si, enfin, l’état du système est tel que G soit minimal, ce système est en équilibre vis-à-vis des transformations réelles isothermes et isobares ; la fonction enthalpie libre est le potentiel thermodynamique à p et T constants.
Ces notions et ces propriétés reçoivent de nombreuses et importantes applications : citons l’étude du changement d’état physique du corps pur, ainsi que la thermodynamique chimique, où les notions précédentes conduisent à la relation fondamentale des équilibres chimiques, dite loi d’action de masse.
R. D.
poterie
Fabrication des pots de terre cuite ; objet en terre cuite.




