nitrique
Relatif à l'oxacide HNO3 et à ses dérivés : anhydride N2O5.
L'anhydride nitrique N2O5 est un solide blanc très difficile à conserver puisqu'il fond à 30 °C. On le prépare en déshydratant l'acide nitrique par l'anhydride phosphorique.
L'acide nitrique HNO3 sous forme monohydratée (N2O5, H2O) fume au contact de l'air, car il donne un hydrate avec la vapeur d'eau de l'atmosphère. Liquide incolore quand il est pur, il bout à 86 °C en se décomposant en eau, dioxyde d'azote et oxygène. La température d'ébullition monte progressivement jusqu'à 122 °C, et il distille alors un mélange azéotrope (contenant 68,4 % d'acide pur) qui est l'acide ordinaire, quadrihydraté (N2O5, 4H2O). L'acide nitrique est un oxydant. Avec tous les non-métaux réducteurs (hydrogène, soufre, phosphore), il donne des acides oxygénés (sulfurique, phosphorique) ainsi que des vapeurs nitreuses. Il oxyde également les composés réducteurs et de nombreux corps organiques, d'où son caractère corrosif.
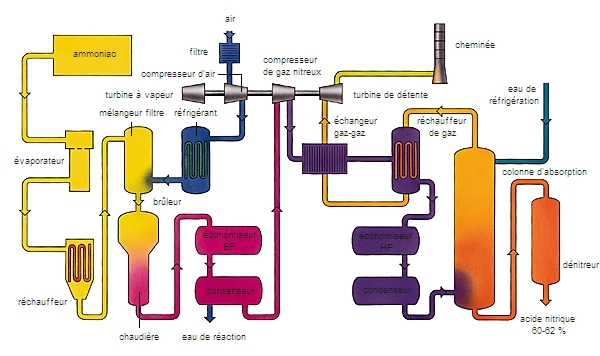
C'est un monoacide fort, qui agit sur les oxydes métalliques et les bases pour donner des nitrates. Il attaque tous les métaux, sauf l'or et le platine, et est utilisé sous le nom d'eau-forte pour la gravure sur cuivre. Fumant, il passive certains métaux comme le fer par formation d'un film d'oxyde protecteur. Avec les composés organiques, il donne des esters nitriques RONO2 et des dérivés nitrés RNO2. Anciennement préparé par attaque à l'acide sulfurique des nitrates naturels, l'acide nitrique est actuellement obtenu en envoyant de l'air enrichi d'ammoniac de synthèse sur une toile de platine rhodié à 800 °C. Les oxydes d'azote recueillis sont transformés par l'eau en acide nitrique dilué qui peut être concentré par distillation.
Il est employé dans l'industrie des engrais, des explosifs minéraux ou organiques et des colorants.