ammoniac
(latin ammoniacum, du grec Ammoniakon, de Ammôn, nom grec d'Amon, dieu égyptien, parce qu'on préparait autrefois cette substance en Libye, près de son temple)

Combinaison gazeuse d'azote et d'hydrogène de formule NH3 existant à l'état libre ou dissoute dans l'eau. (Cette solution, qui ne constitue pas une combinaison, est appelée ammoniaque.)
L'ammoniac, dont la solution était connue depuis le xve s., a été isolé à l'état gazeux par Priestley en 1774. C'est Berthollet qui, en 1785, en a donné la composition exacte. C'est un gaz incolore, d'odeur vive, piquant les yeux, plus léger que l'air (densité 0,60), se liquéfiant aisément, à – 33 °C sous la pression atmosphérique. Particulièrement soluble dans l'eau, qui en dissout 1 000 volumes à 0 °C, il se sépare de la solution par chauffage de celle-ci. Il brûle dans l'oxygène en donnant de la vapeur d'eau et de l'azote. Son oxydation, catalysée par le platine, fournit de l'acide nitrique. Dans le sol, les composés ammoniacaux subissent une oxydation analogue en formant des nitrates (nitrification). L'ammoniac donne avec les acides des sels d'ammonium contenant l'ion NH4+.
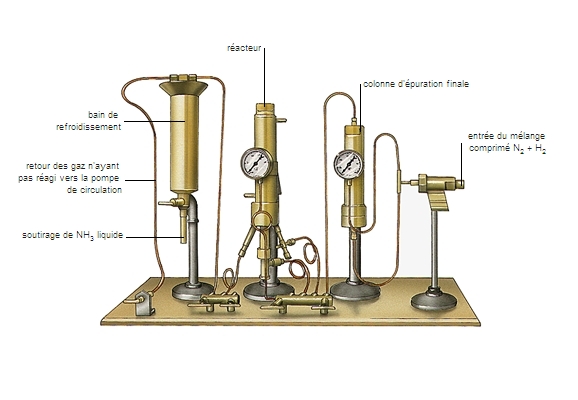
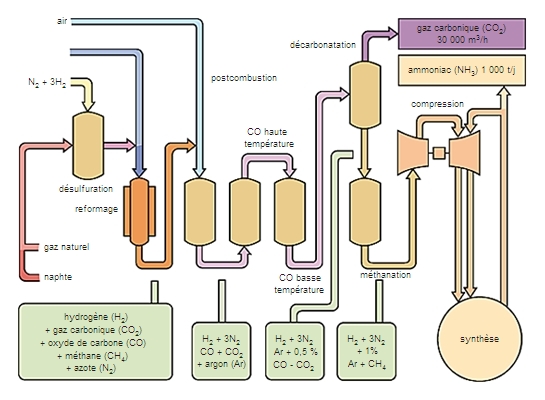
Les matières organiques azotées, sous l'influence de certains ferments, se décomposent en donnant de l'ammoniac. Le procédé de préparation industrielle le plus important est la synthèse directe à partir de l'azote et de l'hydrogène : N2 + 3H2⇆2NH3, sous forte pression et en présence d'un catalyseur. L'hydrogène est obtenu par vapocraquage de gaz naturel, de gaz de raffinerie ou d'essence lourde, ou encore par craquage à l'oxygène. L'azote est fourni par l'air, directement ou par liquéfaction. L'ammoniac est un composé très important. Les sels ammoniacaux servent comme engrais azoté. L'ammoniac sert à fabriquer l'acide nitrique, les nitrates, les nitrites, le carbonate de sodium (par le procédé Solvay) et l'urée. La solution ammoniacale est employée comme dégraissant et comme caustique et l'ammoniac comme fluide frigorigène.