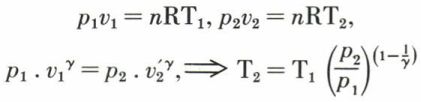Pour un gaz, opération inverse de la compression : un gaz éprouve une détente lorsqu’on augmente le volume qui lui est offert et que de ce fait sa pression diminue.
La détente d’un gaz peut être effectuée de plusieurs façons différentes ; d’une part, les parois du récipient de volume variable qui contient le gaz peuvent être ou non perméables à la chaleur : la détente peut être isotherme si les parois sont très conductrices de la chaleur, elle est par contre adiabatique si les parois ne conduisent pas la chaleur ; d’autre part, le travail des forces de pression du gaz peut être, dans une mesure plus ou moins importante, recueilli à l’extérieur, en particulier, la détente du gaz peut être effectuée dans le vide, c’est-à-dire dans un espace séparé de l’extérieur par des parois rigides, mais initialement complètement vide : le travail des forces de pression du gaz est un travail interne, et il n’y a pas de travail échangé avec le milieu extérieur.
On peut aussi, comme pour toute transformation thermodynamique, classer les détentes suivant leur degré d’irréversibilité : la détente d’un gaz dans le vide, la détente à travers un tampon poreux (ou un robinet à pointeau) sont irréversibles ; en revanche, on s’approche de la réversibilité mécanique si le gaz, en se détendant, repousse lentement un piston bien lubrifié qui lui oppose à chaque instant une résistance presque égale aux forces de pression exercées par le gaz. Le travail produit par le gaz depuis le début jusqu’à la fin de la détente est alors : 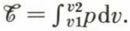 Si la détente est isotherme, et si le gaz obéit à la loi de Mariotte, on a pv = p1v1 = p2v2, et
Si la détente est isotherme, et si le gaz obéit à la loi de Mariotte, on a pv = p1v1 = p2v2, et

Si la détente est adiabatique et si le gaz obéit à l’équation de Laplace, on a :

Pour une même masse de gaz, si les conditions initiales (p1, v1, T1) sont les mêmes, et si la pression p2 en fin de détente est la même, le travail produit par le gaz dans la détente adiabatique est inférieur à celui de la détente isotherme ; dans la détente adiabatique, en effet, le gaz se refroidit en se détendant, ce qui accroît la diminution de pression, donc diminue aussi le travail produit. Cet abaissement de température est facilement calculable pour un gaz parfait, pour lequel on a :
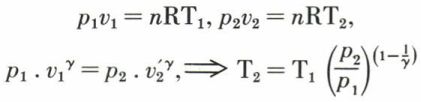
On voit que, pour un gaz diatomique (γ = 7/5) subissant un rapport de détente p1/p2 = 20, on a, si
T1 = 273 °K,
T2 = 273 . (1/20)2/7 = 116 °K,
soit un abaissement de 157 °K ; il serait moindre dans la réalité, mais cependant intéressant pour la liquéfaction d’un gaz.
La question s’est posée de savoir si la détente d’un gaz dans le vide, c’est-à-dire sans travail extérieur, entraîne un changement de température du gaz, supposé thermiquement isolé (détente à énergie interne constante) ; L. J. Gay-Lussac* puis J. P. Joule* avaient conclu par la négative, mais leurs expériences étaient peu précises ; G. A. Hirn (1865) mit en évidence un léger refroidissement. Ce refroidissement est lié au fait que, pour un gaz réel, l’énergie interne est, à température constante, une fonction croissante du volume, en raison des attractions intermoléculaires.
La détente dite « de Joule-Thomson » à travers un tampon poreux s’effectue à enthalpie* constante, du moins si le gaz est thermiquement isolé ; l’expérience montre pour tous les gaz un refroidissement par détente, si température et pression initiales ne sont pas trop élevées ; sinon, il y aurait réchauffement ; l’hydrogène et l’hélium paraissent faire exception, car pour eux la détente à partir des températures ordinaires amène un réchauffement ; en fait, pour ces gaz difficilement liquéfiables, le domaine du refroidissement par détente de Joule-Thomson se situe aux très basses températures ; pour l’hydrogène, la détente à partir d’une pression faible n’amène un refroidissement que si la température initiale du gaz est inférieure à – 80 °C environ, qui est sa température d’inversion.
Industriellement, on utilise la détente des gaz :
1o pour abaisser leur température, en vue de leur liquéfaction ; la détente avec travail extérieur (procédé Claude de liquéfaction de l’air) est plus efficace, mais difficile à réaliser aux très basses températures, auxquelles on emploie encore volontiers la détente à travers un robinet à pointeau ;
2o pour produire de l’énergie mécanique à partir d’énergie thermique a) dans les moteurs à piston, à vapeur ou à gaz (machine à vapeur, moteur à combustion interne ou à air comprimé), sur le piston desquels on recueille le travail de la pression du gaz ; b) dans les turbines à gaz, où l’énergie potentielle du gaz comprimé et chaud est, par détente progressive, transformée en énergie cinétique, elle-même absorbée au contact des aubes de la turbine en rotation.
R. D.






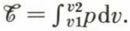 Si la détente est isotherme, et si le gaz obéit à la loi de Mariotte, on a pv = p1v1 = p2v2, et
Si la détente est isotherme, et si le gaz obéit à la loi de Mariotte, on a pv = p1v1 = p2v2, et