mésomérie
Caractère d'un composé chimique dont l'état réel de la molécule n'est pas exactement représentable par une formule développée unique, mais est intermédiaire entre les états fictifs correspondant à plusieurs formules qui diffèrent non par la disposition spatiale des atomes mais par la répartition des électrons de liaison.
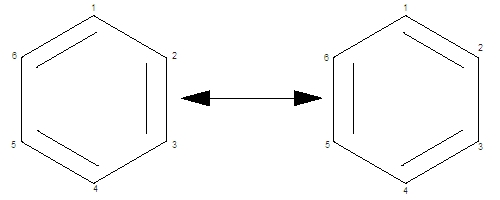
Le concept de mésomérie a été introduit par le chimiste américain Linus Carl Pauling (1901-1994). La mésomérie concerne de nombreux composés dont la formule classique fait appel aux symboles de liaisons multiples : par exemple, les dérivés oxygénés du soufre, de l'azote, du carbone et les composés organiques ; le benzène, en particulier offre un exemple typique d'une molécule dont les schémas classiques, tel celui de Kekulé, ne donnent qu'une représentation approchée. L'énergie réelle de la molécule d'un corps mésomère est inférieure aux énergies correspondant aux états représentés par les formules limites ; la différence, appelée énergie de résonance ou de stabilisation, traduit le fait que la molécule réelle est plus stable que ses représentations fictives ne le laissent supposer.