thérapie génique ou génothérapie

Cet article est extrait de l'ouvrage « Larousse Médical ».
Méthode thérapeutique utilisant les gènes et l'information dont ils sont porteurs pour traiter une maladie génétique ou pour modifier un comportement cellulaire.
La thérapie génique est aussi envisagée comme une technique thérapeutique applicable à des maladies non héréditaires telles que le cancer ou le sida. Dans ces cas, la stratégie consiste à faire entrer dans les cellules malades (et dans aucune autre) un gène capable de les tuer.
Historique
La thérapie génique a été appliquée pour la première fois à l'homme en 1989, aux États-Unis, mais c'est en 1990 seulement que la première expérience à visée véritablement thérapeutique a eu lieu, dans le même pays, au bénéfice d'un enfant atteint d'une maladie héréditaire rarissime, le déficit en adénosine désaminase. Peu après, cette nouvelle méthode gagne l'Europe ; elle est expérimentée pour la première fois en France en 1993.
Plus de 80 % des recherches menées actuellement concernent le traitement du cancer. Les tentatives de thérapie génique de maladies héréditaires sont moins nombreuses.
Indications
La thérapie génique n'a pas d'indications, au sens habituel du terme, puisqu'elle n'est encore qu'au début de sa phase expérimentale : un médecin qui ne participe pas à un travail de recherche ne peut proposer à ses patients de les soigner par thérapie génique. On peut cependant citer les maladies qui ont donné lieu à des expériences thérapeutiques chez l'homme ou qui semblent sur le point d'en faire l'objet : maladies héréditaires (déficit en adénosine désaminase, hémophilie, hypercholestérolémie familiale, mucoviscidose), cancers (leucémie, mélanome malin, cancer des bronches, du cerveau, du côlon, de l'ovaire, du rein, du sein), maladies infectieuses (hépatite virale grave, sida), maladie de Parkinson, etc.
Des essais sont également engagés de stimulation du développement du circuit vasculaire par thérapie génique, ceci afin de contrebalancer les effets ischémiques de l'athérosclérose coronaire sur le myocarde. D'autres tentatives sont menées dans le traitement de certaines affections hématologiques touchant les cellules circulantes, ainsi que dans celui de certains déficits immunitaires chez l'enfant.
Différents types de thérapie génique
La thérapie génique utilise un gène qu'elle introduit dans des cellules du malade. Selon la nature des cellules touchées, on distingue deux méthodes.
La thérapie génique germinale, ou thérapie génique sexuelle, consisterait à appliquer la thérapie génique à un embryon, au stade où celui-ci est formé d'un amas de cellules, ou aux cellules germinales (ovules, spermatozoïdes) d'un adulte. Le gène introduit serait alors transmis à toutes les cellules filles des premières cellules embryonnaires, c'est-à-dire à toutes les cellules du futur individu : il y aurait donc modification du patrimoine génétique de l'espèce humaine. De plus, les cellules germinales du futur individu étant touchées comme les autres, le nouveau patrimoine serait transmis héréditairement à toute sa descendance.
Une telle approche thérapeutique viole le principe qui veut qu'on ne touche jamais au patrimoine héréditaire d'un individu et est donc formellement interdite, de peur qu'elle ne soit progressivement utilisée pour des indications non justifiées (par exemple pour corriger des défauts non invalidants mais simplement disgracieux), puis à des fins d'eugénisme.
La thérapie génique somatique consiste à introduire les gènes exclusivement dans des cellules somatiques (non sexuelles). C'est à cette technique que se limite actuellement le champ d'activité et de recherche en thérapie génique.
La thérapie génique somatique repose sur le fait que, dans l'organisme, chaque cellule est spécialisée et ne possède que quelques fonctions qui lui sont propres : ainsi, une cellule du foie peut éliminer certaines substances toxiques (produites par l'organisme ou d'origine alimentaire, comme l'alcool) ou fabriquer de l'albumine mais est incapable de fabriquer des anticorps (ceux-ci étant exclusivement fabriqués par les lymphocytes).
Pour soigner une maladie héréditaire, il n'est donc pas nécessaire de corriger le défaut génique dans toutes les cellules de l'organisme mais simplement dans celles des organes touchés : ainsi, en cas de myopathie, maladie congénitale résultant d'une altération des fibres musculaires, la correction du défaut n'est nécessaire que dans les muscles.
Technique de la thérapie génique somatique
Dans la pratique, la technique à employer dépend entièrement de l'organe (ou des organes) en cause. Plus il est difficile d'accès (comme par exemple le cerveau), plus la thérapeutique sera techniquement difficile.
Le cas le plus simple est celui où le défaut se manifeste dans le sang, comme cela se produit dans l'hémophilie, maladie caractérisée par l'absence d'une protéine (le facteur VIII) qui participe au mécanisme de la coagulation. Il suffit alors d'introduire le « bon » gène, produit en laboratoire, soit dans une cellule du sang de très longue durée de vie (lymphocyte, par exemple), soit dans les cellules qui constituent les parois des vaisseaux. Les cellules qui auront reçu le bon gène liront l'information qu'il porte, fabriqueront en conséquence la protéine manquante et la rejetteront dans le sang : le défaut sera ainsi corrigé.
Le problème est plus complexe lorsque le défaut est situé dans une partie très difficilement accessible du corps. Dans le cas de la myopathie, le « bon » gène doit être introduit dans une grande proportion des cellules musculaires (au moins 20 % dans la myopathie de Duchenne, par exemple). Dans quelques cas particuliers, cependant, la modification d'un très petit nombre de cellules est suffisante, par exemple lors de certains déficits immunitaires de l'enfant, pour lesquels la manipulation génétique est amplifiée par la prolifération des quelques cellules auxquelles la thérapie génique a été appliquée.
La nécessité d'introduire le gène favorable dans un grand nombre de cellules constitue néanmoins dans la plupart des cas l'une des difficultés principales de la thérapie génique. À cette fin, il est indispensable de confier le gène à un vecteur, élément capable de l'apporter à toutes les cellules qui en ont besoin.
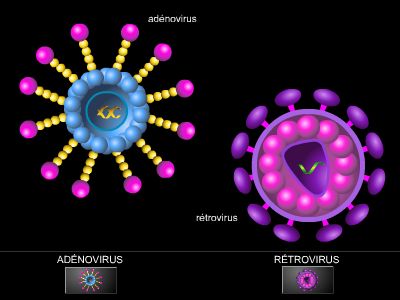
Dans l'état actuel de la technique, les vecteurs les plus utilisés sont des virus rendus inoffensifs par un traitement en laboratoire. Les virus sont en effet capables d'infecter les cellules en s'introduisant en elles. Si le bon gène leur a été ajouté, la cellule infectée le recevra simultanément. Le virus ayant été rendu inoffensif, il n'aura aucun effet, mais la cellule, qui aura ainsi récupéré le bon gène, verra son défaut corrigé.
Dans la pratique, plusieurs stratégies ont été imaginées et commencent à être utilisées. Aucune n'est cependant tout à fait satisfaisante et la thérapie génique restera pour quelques années encore purement expérimentale. Jusqu'à présent, deux stratégies différentes sont en cours de mise au point.
La technique in vitro consiste à recueillir des cellules de l'individu à traiter (par exemple des lymphocytes, par une simple prise de sang) et à y introduire les bons gènes soit par transfection (technique de laboratoire qui permet d'introduire de l'A.D.N. dans une cellule à noyau), soit grâce à des virus. Ces cellules, qui possèdent alors le bon gène, sont réintroduites dans le sang par une injection intraveineuse. La première expérience de thérapie génique (thérapie du déficit en adénosine désaminase) a été réalisée ainsi. Cette stratégie ne peut être utilisée que pour des défauts génétiques se manifestant dans le sang ou localisés dans des cellules que le sang peut atteindre.
La technique in vivo consiste en général à associer le bon gène à un vecteur (un virus par exemple), qui sera capable de le transporter là où sa présence est nécessaire. Pour être efficace, il faut que celui-ci soit capable d'accéder spécifiquement à toutes les cellules qui doivent être corrigées et d'y pénétrer. Cette technique reste encore plus théorique que pratique.
Dans certains cas particuliers, il est possible de corriger le gène sans utiliser de virus. Ainsi, le symptôme le plus invalidant de la mucoviscidose est l'augmentation de la viscosité des sécrétions des bronches, à l'origine de difficultés respiratoires ; pour le supprimer, il suffit de corriger les cellules qui constituent les parois des bronches. La solution consiste à fabriquer des micro-gouttelettes, composées du bon gène que l'on veut apporter et de certaines graisses, et à les mélanger à de l'air pour constituer un aérosol que l'on donne à respirer au malade : les microgouttelettes se déposent sur les cellules qui tapissent les parois des bronches, qui de ce fait captent le bon gène et sont ainsi corrigées. Une autre possibilité de traitement in vivo consiste à créer en laboratoire un minuscule organe artificiel, appelé organoïde, constitué de cellules contenant le gène qui fait défaut au malade. Pour cela, un petit morceau de Téflon est déposé sur une culture de fibroblastes (cellules constituant l'essentiel du tissu conjonctif de l'organisme), qui se fixent spontanément sur lui et prolifèrent, l'ensemble formant alors un tout petit organe artificiel. Comme chacune des cellules qui le constituent contient le bon gène, celles-ci peuvent utiliser l'information qu'il porte pour fabriquer la protéine qui manque au malade : cet organoïde est donc comme une petite usine fabriquant la protéine manquante. Il serait alors greffé là où celle-ci est nécessaire.
Ces techniques ne peuvent s'appliquer qu'aux maladies héréditaires à transmission récessive ou dues à un défaut d'un seul gène : il « suffit » alors de pallier la fonction manquante en apportant le gène qui pourra l'assurer. Mais, parfois, le problème à résoudre est plus complexe. C'est le cas notamment des maladies polygéniques (où plusieurs gènes sont en cause, le défaut de chacun d'entre eux devant être corrigé) et des maladies héréditaires à transmission dominante, dont les symptômes ne sont pas liés à la perte d'une fonction dont un gène était responsable, mais au fait que le gène altéré conduit à la fabrication d'une substance toxique ; il faut alors non seulement apporter le gène manquant, mais détruire de surcroît le gène défectueux.
Enfin, il est parfois trop tard pour agir. Ce cas se présente principalement lors de maladies neurologiques caractérisées par une destruction ou une altération des cellules nerveuses, qui ne se renouvellent pas. Apporter le bon gène ne sert alors à rien puisque les dégâts sont irréversibles, les cellules ne pouvant être remplacées.
Limites de la thérapie génique
Il est actuellement difficile de parler des résultats de la thérapie génique, puisque celle-ci n'est encore qu'en phase expérimentale. Même si l'on connaissait un pourcentage global d'efficacité, il serait seulement indicatif et n'aurait aucune valeur statistique, étant donné le nombre infime de malades traités. On peut néanmoins indiquer que certaines expériences ont été interrompues à cause d'effets indésirables, et que l'on parle pour l'instant, pour les expériences en cours ou terminées, davantage d'amélioration des symptômes que de guérison.






