césium
(latin caesius, bleu)

Métal alcalin mou, jaune pâle, chimiquement réactif, le plus électropositif de tous les métaux. (Élément chimique de symbole Cs.)
- Symbole : Cs
- Numéro atomique : 55
- Masse atomique : 132,905
- Masse volumique : 1879 kg/m3
- Température de fusion : 28,4 °C
- Température d'ébullition : 671 °C
1. Découverte du césium

Le césium a été découvert en 1860 par le chimiste allemand Robert Bunsen et le physicien allemand Gustav Kirchhoff par analyse spectrale. L’origine de son nom vient du latin caesius, signifiant « bleu ciel », en référence à ses deux raies spectrales caractéristiques (à 456 et 459,7 nm) de couleur bleu clair.
2. État naturel et préparation
Le césium est relativement rare : il constitue 0,0007 % de l’écorce terrestre. Dans la nature, on le trouve dans certaines eaux minérales, dans le lépidolite et le pollux (silicoaluminate de césium). Son extraction est longue et complexe : il est obtenu par décomposition sous vide de son chlorure fondu en présence de calcium, suivi d’une distillation.
Le césium commercial contient généralement du rubidium, souvent présent avec le césium dans les minéraux et qui présente de nombreuses similitudes chimiques avec lui.
Le césium peut être purifié par distillation fractionnée sous vide moléculaire et est conservé en ampoule scellée.
3. Propriétés du césium
3.1. Propriétés physico-chimiques
Avec le gallium et le mercure, le césium est l’un des trois métaux qui se présente à l’état liquide à température ambiante (point de fusion du césium de 28,4 °C).
Il présente un seul degré d’oxydation correspondant à l’espèce ionique Cs (+I).
Du fait de son électropositivité élevée, il s’oxyde très facilement : mis en contact avec l’air, le césium s’enflamme instantanément, ce qui explique sa conservation en ampoule scellée. Sa réaction à froid avec l’eau produit de l’hydrogène et de l’hydroxyde de césium (CsOH), également appelé césine.
3.2. Propriétés nucléaires

Le césium possède 39 isotopes, dont les nombres de masse varient de 112 à 151. Parmi eux, seul le césium 133 est stable. Tous les autres isotopes du césium sont instables et présentent des périodes radioactives (ou temps de demi-vie, temps au bout duquel la moitié des noyaux radioactifs, initialement présents, se sont désintégrés) relativement courtes (inférieures à quelques jours), à l’exception du césium 134 (2 ans), du césium 135 (2,3 millions d’années) et du césium 137 (30 ans).
Ce dernier est le radionucléide le plus connu de la série, car il constitue la principale source de radioactivité des déchets des réacteurs nucléaires (avec le strontium 90 et différents isotopes du plutonium). De plus, il est l’une des principales sources de contamination radioactive lors des accidents de réacteurs nucléaires, dont les plus connus sont ceux des centrales de Three Miles Island (États-Unis) en 1979, de Tchernobyl (Ukraine) en 1986 et de Fukushima (Japon) en 2011.
4. Utilisations du césium
L’horloge atomique au césium (133Cs), qui sert à définir l’unité de temps du Système international d’unités (la seconde), constitue l’utilisation la plus connue de cet élément chimique. Depuis 1967, la seconde est définie par le Bureau international des poids et mesures comme « la durée de 9 192 631 770 périodes de la radiation correspondant à la transition entre les deux niveaux hyperfins de l'état fondamental de l'atome de césium 133 ».
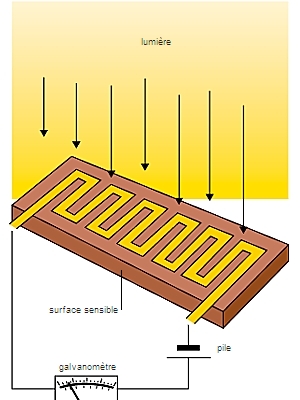
Par ailleurs, du fait de son faible potentiel d’ionisation, le césium (133Cs) est principalement employé dans la fabrication de certaines cellules photoélectriques. Il peut également être utilisé pour piéger les gaz résiduels dans les tubes à vide et comme ion propulseur dans les moteurs ioniques.
Enfin, bien que présentant des risques pour l’environnement et la santé en raison de ses propriétés radiologiques, le césium 137 est utilisé pour ses rayons gamma dans l’industrie et en médecine, notamment dans le traitement local de tumeurs cancéreuses, ainsi que dans le contrôle non destructif de pièces métalliques, de soudures ou d’ouvrages d’art.