esters
Homologues les plus généraux de l’acétate d’éthyle CH3—COOC2H5, obtenu dès le xviiie s. par action de l’alcool sur l’acide acétique en présence d’acide sulfurique. Leur formule générale est R—COOR′ (ou R—COOAr), et la nomenclature la plus usuelle les désigne comme les sels : CH3—COOC2H5 s’appelle acétate d’éthyle, comme CH3—COONa s’appelle acétate de sodium ; elle maintient ainsi une fausse analogie entre l’estérification et la salification ; d’ailleurs, jusqu’en 1900, les esters étaient appelés éthers-sels. Beaucoup de chimistes groupent sous le nom d’esters les esters carboxyliques et les esters des acides minéraux, mais cet article traite exclusivement des premiers.
Les esters existent nombreux parmi les produits naturels ; quelques-uns dérivent d’un monoacide et d’un monoalcool, mais les plus importants, les corps gras ou lipides, dérivent de plusieurs monoacides et d’un trialcool, le glycérol.
Estérification
Les esters se forment réversiblement par action d’un acide carboxylique sur un alcool (exceptionnellement un phénol) :
R—COOH + R′OH ⇌ H2O + R—CO—O—R′.
L’introduction, dans l’alcool, de l’isotope 18O, qui se retrouve dans l’ester et non dans l’eau formée, a permis d’établir le schéma réactionnel
ce qui éloigne fondamentalement l’estérification de la salification.
Il convient d’étudier simultanément l’estérification et la réaction inverse, l’hydrolyse.
En milieu homogène, l’estérification est une réaction bimoléculaire dans les deux sens ; au départ de quantités équimolaires d’acide et d’alcool, l’équilibre correspond à une quantité d’ester présent indépendante de la pression et peu sensible à la température ; mais cet équilibre est atteint d’autant plus rapidement que la température est plus élevée.
La limite est peu sensible à la nature de l’acide, mais beaucoup plus à celle de l’alcool (ou du phénol) ; elle varie de 67 à 73 p. 100 pour les alcools primaires, de 60 à 65 p. 100 pour les alcools secondaires ; pour les alcools tertiaires et les phénols, elle ne dépasse guère 8 p. 100. Par contre, la vitesse d’estérification varie à la fois avec la nature de l’acide et avec celle de l’alcool. En principe, les acides les plus forts (acide formique) sont les plus actifs, et les alcools primaires s’estérifient plus vite que les alcools secondaires et, a fortiori, tertiaires ; mais l’empêchement stérique a une influence marquée sur la vitesse (mais non sur l’équilibre) ; c’est ainsi que, par l’acide acétique, l’alcool primaire encombré (CH3)3C—CH2OH s’estérifie moins vite que l’alcool secondaire CH3—CHOH—CH3.
L’ion H+ est le seul catalyseur de l’estérification, mais l’hydrolyse est catalysée à la fois par l’ion H+ et par l’ion OH–, le second étant environ 105 fois plus actif que le premier ; on en conclut, par un calcul simple, que le pH d’hydrolyse minimale se situe aux environs de 4,5.
La préparation des esters par cette méthode peut être rendue plus quantitative par divers artifices : déplacement de l’équilibre par une quantité suffisante d’acide sulfurique qui s’empare de l’eau formée, élimination de celle-ci par distillation ou sous forme d’azéotrope avec le benzène, etc.
Quant à l’hydrolyse, elle devient rapide et totale en présence de la quantité stœchiométrique d’une base forte :
R—COOR′ + NaOH → R—COONa + R′OH.
On l’appelle alors saponification, car, appliquée aux corps gras, elle conduit d’une part, au glycérol et, d’autre part, à des sels d’acides gras (savons).
Les esters sont accessibles par d’autres procédés, dont trois sont quantitatifs :
a) action d’un chlorure d’acide (ou d’un anhydride) sur un alcool primaire ou secondaire :
R—COCl + HOR′ → HCl + R—COOR′ ;
b) action d’un éther halohydrique sur un sel de sodium (ou d’argent) :
R—COONa + R′Br → NaBr + R—COOR′ ;
c) action d’un alcool primaire sur un nitrile en présence de HCl :
L’hydrolyse libère R—COOC2H5 et NH4Cl.
Enfin, la réaction équilibrée
R—COOR′ + R″OH ⇌ R—COOR″ + R′OH,
appelée alcoolyse ou transestérification, permet la transformation partielle d’un ester en un autre.
Propriétés physiques
Les esters sont généralement des liquides odorants ; certains constituent des parfums ; le formiate de méthyle HCO2CH3 est, toutefois, gazeux.
Les termes les plus simples sont miscibles à l’eau, mais déjà l’acétate d’éthyle ne présente plus qu’une faible solubilité dans l’eau. Les termes élevés, en particulier les corps gras, sont insolubles dans l’eau (composés liposolubles).
De nombreux esters sont employés comme solvants.
Propriétés chimiques
a) Le sodium et l’alcool absolu réduisent les esters en deux alcools, dont l’un au moins est primaire ; schématiquement
R—COOR′ + 4 H → R—CH2OH + R′OH (Bouveault).
Mais cette réduction peut être réalisée par les hydrures doubles (AlH4Li) ou, catalytiquement, en présence de chromite de zinc ; elle permet alors la transformation directe des corps gras en glycérol et en alcools gras.
b) La plupart des réactions des esters s’interprètent par la coupure schématique :
R—COOR′ → R—CO+ + R′O–.
C’est le cas pour l’hydrolyse et l’alcoolyse, déjà signalées.
L’ammoniac et les amines non tertiaires se comportent de façon analogue :
R—COOR′ + R″NH2 ⇌ R′OH + R—CO—NH—R (amide).
c) Les organomagnésiens conduisent, après hydrolyse, à des alcools :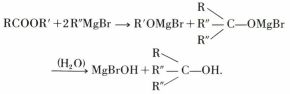
d) PCl5 coupe les esters en deux dérivés halogènes :
R—COOR′ + PCl5 → OPCl3 + R′Cl + R—COCl.
e) Les carbanions, résultant de l’action d’un alcali sur un composé à hydrogène mobile (cétone, ester), amènent, par élimination d’un ion alcoolate, des condensations (importantes réactions de Claisen) :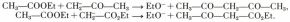
f) Le sodium conduit, après hydrolyse, à une acyloïne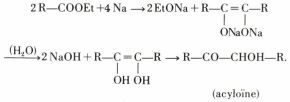
C. P.




