thermodynamique

Branche de la physique qui étudie les propriétés des systèmes où interviennent les notions de température et de chaleur.


La thermodynamique est essentiellement issue des travaux de S. Carnot, qui énonça le « second principe » en 1824, de Joule, qui énonça le « premier principe » en 1840, et de Clausius (1850). La description des systèmes thermodynamiques est liée à la notion de système et d'état de ce système. Les équations d'état précisent les relations existant entre les diverses variables d'un système donné. Ainsi, les variables intensives (qui ne dépendent pas de la taille du système) d'un gaz parfait, pression p et température T, sont liées aux variables extensives (qui dépendent de sa taille), volume V et nombre de molécules N, par l'équation p V = NRT, où R est la constante des gaz parfaits. Les changements d'état d'un système, qui peuvent être dus à un échange de travail et/ou de chaleur avec le milieu extérieur, aboutissent en général à un état d'équilibre, caractérisé par des variables constantes dans le temps. Lorsqu'un système ne peut échanger ni matière, ni travail, ni chaleur avec l'extérieur, il est dit « isolé ».
Les principes de la thermodynamique permettent de prévoir l'évolution macroscopique des systèmes et leurs états d'équilibre.
Principe zéro
« Deux corps en équilibre thermique avec un même troisième sont en équilibre thermique entre eux. ».
Premier principe
Il existe une fonction U (l'énergie interne) dont la variation au cours d'une transformation dépend uniquement de l'état initial et de l'état final. Pour un système fermé, cette variation s'écrit
ΔU = W + Q,
où W est le travail et Q la quantité de chaleur reçus par le système. Les quantités W et Q sont algébriques. Pour la physique statistique, l'énergie interne est définie comme la somme des énergies cinétiques et d'interaction de ses constituants microscopiques ; le premier principe énonce alors tout simplement la conservation de l'énergie.
Deuxième principe (ou principe de Carnot)
Il exprime l'irréversibilité des processus macroscopiques spontanés. Il existe de nombreux énoncés, tous équivalents, du deuxième principe :
– énoncé de Clausius : il n'existe pas de processus dont le seul effet serait de faire passer de la chaleur d'une source froide à une source chaude ;
– énoncé de Kelvin : il n'existe pas de moteur thermique qui puisse fournir du travail à partir d'une seule source de chaleur ;
– formulation à l'aide de l'entropie : au cours d'une transformation, la variation d'entropie ΔS ne dépend que de l'état initial et de l'état final et vérifie la relation :
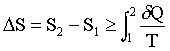
, où δQ est la quantité de chaleur reçue par le système lorsque sa température est T. Cette relation devient une égalité lorsque la transformation est réversible.
L'évolution spontanée d'un système isolé se traduit donc toujours par une augmentation de son entropie, puisque la quantité de chaleur qu'il reçoit est nulle. L'état d'équilibre thermodynamique d'un système est l'état compatible avec les contraintes extérieures pour lequel l'entropie prend la valeur maximale.
Troisième principe
À la température 0 K, l'entropie de tous les systèmes est nulle.
Les deux premiers principes s'expriment sous forme mathématique en écrivant que la fonction d'état caractéristique du système est une différentielle. Les fonctions d'état les plus utilisées sont l'énergie interne U et l'enthalpie H. Les relations obtenues permettent de prévoir le comportement des systèmes thermodynamiques.







