génome
(de gène)

Ensemble du matériel génétique, c'est-à-dire des molécules d'ADN, d'une cellule ou d’une espèce.
LE GÉNOME HUMAIN
Le Projet génome humain
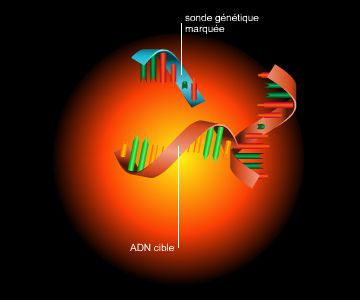
Les avancées récentes de la génétique médicale découlent des progrès enregistrés dans la connaissance de nos gènes, grâce à la généralisation de techniques d'étude de l'ADN mises au point à partir de 1974 et regroupées sous le terme « génie génétique ». De brillants succès ont ainsi été remportés, avec la mise en évidence des gènes impliqués dans des affections héréditaires majeures comme la myopathie de Duchenne (1986), la mucoviscidose (1989) ou la chorée de Huntington (1993).

Parallèlement à ces travaux s'engageait une étude d'ensemble coordonnée et systématique de notre patrimoine génétique, dont les résultats ont donné un formidable coup d'accélérateur à la recherche sur les maladies génétiques. Proposé dès 1985 aux États-Unis (la première réunion sur le séquençage du génome humain se tint cette année-là à l'université de Californie de Santa Cruz), le Projet génome humain (Allemagne, Chine, États-Unis, France, Grande-Bretagne et Japon) a démarré officiellement en octobre 1990. Plus que d'un projet unique, il s'agit d'une série de programmes nationaux liés par de nombreuses collaborations, et abordant l'analyse de notre ADN à trois niveaux : cartographie génétique, cartographie physique et, enfin, séquençage. Le séquençage complet du génome humain a été publié en 2003, refermant le Projet. Les retombées médicales de ces travaux sont déjà considérables et vont aller en s'amplifiant, notamment par la caractérisation des gènes qui sont à l'origine des 5 000 maladies génétiques répertoriées à ce jour et, donc, d'en améliorer le diagnostic et, à plus long terme, d'en permettre la guérison par thérapie génique (traitement des maladies par modification des gènes). .
Résultats du séquençage du génome humain

Après le séquençage complet de deux chromosomes (21 et 22) et une première cartographie (carte à deux centimorgans) quasi complète du génome humain en 2000, la publication de la totalité du séquençage, en avril 2003, a permis de revoir à la baisse les estimations initiales, annonçant entre 60 000 et 140 000 le nombre total des gènes porteurs de l'information pour fabriquer les protéines. En fait, le séquençage complet a révélé que, contrairement aux prévisions antérieures, le génome humain ne comprendrait qu'environ 25 000 à 30 000 gènes (soit à peine 13 000 de plus que le génome de la mouche Drosophile) : une des surprises révélées par ce séquençage est en effet l'existence, au sein de nos chromosomes, de « vastes étendues de régions génétiquement désertiques » correspondant à de longs enchaînements d'ADN dont tout indique, dans l'état actuel de nos connaissances, qu'ils ne correspondent à aucun gène. Cet ADN « répétitif » auquel on ne peut attribuer aucune fonction particulière connue, correspondrait en fait à près du tiers du génome. Si certains chromosomes (ceux numérotés 17, 19 et 22) sont particulièrement denses en gènes, d'autres, par contre, semblent quasi-désertiques ; c'est le cas des chromosomes 4, 13 et 18, ainsi que des chromosomes sexuels X et Y.
LES GÉNOMES VÉGÉTAUX
Les techniques de la biologie moléculaire et les méthodes de la génétique ont permis de progresser de façon extraordinaire dans notre connaissance des génomes végétaux. Les résultats qui s'accumulent sur deux espèces modèles « à petit génome », le riz et Arabidopsis, la cartographie génétique, la transgenèse et les nouvelles méthodes de sélection qui en découlent modifient considérablement nos conceptions de l'amélioration des espèces végétales cultivées.
La médiatisation des résultats obtenus sur le décryptage du génome humain, et ses retombées espérées sur le traitement de certaines maladies, a tendance à laisser dans l'ombre les travaux des généticiens travaillant sur les espèces végétales. Il faut cependant garder à l'esprit que les premières causes de mortalité dans le monde aujourd'hui restent la famine et la malnutrition. Les végétaux sont indispensables à toute vie sur Terre. Depuis l'aube de l'humanité, l'agriculture, qui suppose la domestication et la sélection génétique inconsciente puis raisonnée des espèces végétales et animales, est l'activité essentielle qui caractérise les civilisations.
Comme pour le génome humain, et comme pour ceux des animaux et des micro-organismes, le développement des outils et des techniques de la biologie moléculaire a permis de progresser très rapidement dans notre connaissance des génomes végétaux (si parler du « génome humain » reflète avec justesse l'unicité de l'espèce humaine, parler du « génome végétal », au singulier, est absurde à plus d'un titre). Les centaines de milliers d'espèces végétales, des algues unicellulaires aux arbres, en passant par les fougères, les mousses et les plantes herbacées, possèdent chacune une organisation génomique particulière. De plus, dans chaque cellule végétale coexistent et coopèrent 3 génomes : celui du noyau de la cellules, organisé en chromosomes, celui des mitochondries, les usines énergétiques sièges de la respiration, et celui des chloroplastes, ces organites spécifiques des végétaux où a lieu la photosynthèse.
La constitution des génomes
Différentes méthodes sont utilisées pour estimer la taille d'un génome, c'est-à-dire le nombre de paires de bases de l'ADN contenu dans un noyau d'une cellule de l'espèce considérée.
La taille des génomes végétaux
La taille du génome « haploïde », correspondant à la moitié du stock chromosomique, varie de 100 millions de paires de bases (Mb) environ chez Arabidopsis thaliana (ou arabette des dames, petite crucifère cousine du colza devenue une espèce modèle pour la génétique végétale en partie grâce à la taille de son génome) à 123 000 Mb chez Fritillaria assyriaca (la fritillaire). Ainsi, ces deux espèces de plantes à fleurs (angiospermes dicotylédones) sont constituées des mêmes organes (racines, tiges, feuilles et fleurs) mais ont des dimensions de génomes qui diffèrent de 1 230 fois. (Pour mémoire, la taille du génome humain est d’environ 3 000 Mb.)
Il est vrai que de très nombreuses espèces végétales sont polyploïdes, c'est-à-dire avec plusieurs stocks chromosomiques par noyau. Le blé tendre, par exemple, est un hexaploïde ; son noyau de 42 chromosomes résulte de l'association de 3 génomes d'espèces proches ayant chacune 14 chromosomes. Mais la polyploïdie ne suffit pas à expliquer cette énorme variation de taille puisque ce blé a une taille de génome « haploïde » de 16 000 Mb, alors que le riz (de la même famille des graminées) a un génome de 450 Mb. C'est d'ailleurs la raison pour laquelle, outre son importance agronomique majeure, le riz est devenu l'autre espèce modèle des généticiens des végétaux, représentant les monocotylédones. La tomate (génome de 950 Mb) et le maïs (2 500 Mb) sont aussi des espèces très étudiées par les généticiens.
Comme dans les autres espèces, les génomes nucléaires des végétaux sont organisés en chromosomes, dont le nombre varie de 10 chez l'arabette à plus de 100 chez la canne à sucre. Les chromosomes sont constitués d'une longue double hélice d'ADN entourant des nucléosomes. La chaîne nucléoprotéique constituant ces nucléosomes est plus ou moins condensée selon les phases du cycle cellulaire. Cette organisation en chromosomes permet la réplication puis la ségrégation des gènes à la mitose et à la méiose. Les centromères qui s'attachent au fuseau équatorial lors de la division cellulaire sont essentiels à la régularité de la ségrégation. Les télomères, à chaque extrémité des chromosomes, sont indispensables à la fidélité de la réplication.
Les séquences répétées
Un génome de 100 Mb environ suffit pour le fonctionnement et l'organisation d'une plante à fleur évoluée, ce qui a donné lieu à de nombreuses spéculations sur la fonction de l'ADN apparemment en excès chez les espèces à grand génome. Constitué d'ADN répété, il ne code vraisemblablement pas pour des protéines et son rôle est encore mal connu, il pourrait être impliqué dans des phénomènes de régulation ou d'organisation physique des chromosomes.
Dans les années 1970, les études de cinétique de réassociation de l'ADN ont permis de mieux décrire la complexité des génomes végétaux. On a pu ainsi distinguer les séquences répétées (qui se réassocient rapidement car elles existent en un très grand nombre d'exemplaires) et les séquences dites « uniques », qui se réassocient très lentement. La proportion d'ADN répété est d'autant plus importante que la taille du génome est grande. Ainsi les espèces à grand génome comme le blé ont plus de 80 % de séquences répétées, alors que l'arabette en a autour de 20 %. On distingue deux types de séquences répétées : celles qui sont dispersées dans l'ensemble du génome et celles dites « en tandem », où les séquences identiques sont regroupées et se suivent le long de la molécule.
Parmi les séquences répétées en tandem se trouve l'ADN ribosomique, qui code pour les ARN des ribosomes où s'effectue la synthèse protéique. Plusieurs milliers de copies de cette séquence, dont seule une partie est effectivement transcrite, sont concentrées dans une ou quelques régions chromosomiques et peuvent couvrir plusieurs dizaines de kilobases (milliers de paires de bases). L'autre grand groupe est celui des ADN satellites, ainsi appelés d'après leur position par rapport à la plus grande partie de l'ADN après centrifugation dans un gradient de densité. Ces ADN satellites sont constitués d'unités répétées en tandem dont le motif élémentaire a de 150 à 350 paires de bases. On trouve ces familles de séquences dans les régions télomériques et dans les régions centromériques.
On trouve aussi dans les génomes des végétaux des séquences VNTR (pour Variable Number of Tandem Repeats), mini- ou microsatellites, comme dans les génomes des espèces animales. Ces séquences sont réparties de façon aléatoire le long des chromosomes et sont constituées d'un nombre variable de répétitions d'un motif élémentaire plus ou moins long. Les microsatellites sont des répétitions en tandem d'une courte séquence de 2 à 5 nucléotides. Le polymorphisme important quant au nombre de motifs répétés, constaté entre individus de la même espèce, fait de ces locus microsatellites d'excellents marqueurs pour l'établissement des cartes génétiques. Parmi le groupe des séquences répétées dispersées, la classe la plus abondante est représentée par des séquences caractéristiques des éléments transposables, gènes sauteurs capables de se déplacer (transposition) et de se multiplier au sein du génome. Les séquences de ces transposons, ou de leurs dérivés inactivés, peuvent représenter un pourcentage significatif du génome.
Les séquences « uniques »
Se trouvant en simple copie ou en faible nombre de copies dans un génome donné, elles représentent la fraction accessible à l'analyse génétique classique. Il s'agit des séquences codant pour les gènes exprimés et dont les mutations vont se manifester par une caractéristique particulière, visible à l'œil nu ou accessible à l'analyse biochimique. Cette matière de base des généticiens d'hier est aussi celle de la génétique moléculaire. Le très grand nombre de marqueurs nucléiques aujourd'hui disponibles, par exemple les RFLPs (polymorphismes de la longueur des fragments de restriction), font également fréquemment appel à cette fraction du génome qui est a priori la plus intéressante puisque codant pour des protéines intervenant dans le métabolisme.
L'utilisation de la transcriptase inverse, enzyme qui permet la synthèse d'ADN à partir d'une séquence d'ARN, a servi à isoler les ADN complémentaires (ADN-c) des ARN messagers dans différentes espèces, différents organes, différentes conditions environnementales. Ces ADN-c peuvent être utilisés comme sondes et fournissent ainsi des marqueurs génétiques permettant de différencier pour ces gènes, connus ou inconnus, les formes alléliques, polymorphisme indispensable à l'établissement des cartes génétiques.
La cartographie des génomes
Les cartes génétiques sont construites selon un principe simple : sur un chromosome, la distance entre 2 gènes est proportionnelle au pourcentage de recombinaisons entre ces 2 gènes lors de la méiose (pourcentage déduit de la proportion des différents types d'individus dans la descendance). Avec l'avènement des analyses moléculaires de l'ADN, les cartes génétiques des espèces, jusque-là restreintes aux gènes facilement repérables et aux protéines révélées par des techniques biochimiques, se sont considérablement développées. Chez la plupart des espèces de grande culture ainsi que chez les principales espèces d'arbres forestiers utilisés pour le reboisement, on dispose dorénavant de cartes saturées comportant plusieurs centaines de marqueurs anonymes ou de gènes. Une grande variété de techniques permet la mise en évidence des différents types de marqueurs moléculaires, comme chez les autres espèces (RFLPs, microsatellites…). Les avantages conférés aux plantes par leurs systèmes de reproduction (autofécondation, contrôle des croisements, obtention de lignées parfaitement homozygotes où les 2 allèles (versions) de chaque gène sont identiques, très grand nombre de descendants par individu, etc.) ont facilité l'établissement de ces cartes génétiques.
La cartographie génétique comparative
Dans de nombreux cas, des marqueurs positionnés sur la carte génétique d'une espèce ont été utilisés pour la cartographie d'une autre espèce. On a alors pu constater que l'ordre des gènes ou des marqueurs le long des chromosomes était conservé d'une espèce à l'autre pour des fragments chromosomiques plus ou moins longs. La « synténie » ainsi constatée est d'autant plus grande, et les segments d'autant plus longs, que les espèces sont proches du point de vue évolutif.
C'est ainsi que pour la grande famille des graminées, où l'on trouve des nombreuses plantes d'intérêt agronomique majeur, on peut déduire l'arrangement du génome ancestral et comprendre son évolution (translocations, fragmentations, insertions et duplications de segments chromosomiques). Plus important encore, la localisation d'un gène dans une espèce permet de prédire son emplacement sur la carte génétique d'une autre espèce. On voit ainsi toute l'importance que prennent dès à présent les études faites sur les espèces modèles à petit génome comme le riz pour les graminées et les monocotylédones et l'arabette pour les crucifères (choux, colza, radis) et les dicotylédones.
La cartographie physique
Les cartes génétiques permettent de situer les gènes et les marqueurs les uns par rapport aux autres le long des groupes de liaison. Les méthodes de la cytogénétique, qui se sont naturellement développées sur les espèces à grands génomes, pour lesquelles les chromosomes sont facilement repérables au microscope, ont permis de faire la correspondance entre groupes de liaison et chromosomes. C'est particulièrement le cas du blé tendre : on a construit des lignées où manque une paire de chromosomes ou une paire de bras chromosomique. Cette perte d'un ensemble de gènes n'empêche pas le développement de la plante, qui possède encore deux jeux complets de gènes équivalents du fait de son état hexaploïde. On peut alors déduire de son absence le chromosome porteur du gène que l'on cherche à localiser. L'hybridation in situ de séquences d'ADN rendues fluorescentes permet de les localiser directement sur les chromosomes. Elle permet aussi de décrire la constitution chromosomique de génomes complexes résultant d'hybridations interspécifiques.
Le développement de banques génomiques en YACs (pour Yeast Artificial Chromosomes) où le génome est coupé en morceaux de quelques centaines de kilobases et chaque morceau intégré dans un chromosome artificiel de levure permet d'établir la carte physique du génome. L'ordonnancement des différents YACs et la localisation sur ces derniers des marqueurs amènent à faire la correspondance entre les distances génétiques, mesurées en pourcentages de recombinaisons, et les distances physiques, mesurées en nombre de paires de bases d'ADN. Une fois complétée la carte physique, ce qui sera bientôt le cas de l'arabette et du riz, on peut localiser un gène directement par hybridation de marqueurs proches sur la banque de YACs ordonnée.
Séquences et fonctions
À l'instar des projets en cours sur le génome humain, deux grands types de programmes de séquençage systématique sont en cours chez les végétaux modèles (arabette et riz) : le séquençage des ADN complémentaires et le séquençage génomique.
Le séquençage systématique
Plusieurs milliers d'ADN-c ont été caractérisés par une fraction de leur séquence ; les « étiquettes » ou « signatures » ainsi obtenues peuvent être comparées aux très nombreuses séquences de gènes d'autres organismes, y compris de l'homme, déjà répertoriées dans les banques de données. La recherche des homologies ou des similitudes de séquences permet de faire des hypothèses sur la fonction du gène associé à cette étiquette. Mais, par ces comparaisons, il n'a été possible d'attribuer une fonction qu'à une faible partie des quelque 8 000 différentes étiquettes de l'arabette officiellement répertoriées aujourd'hui. Pour près des deux tiers de ces séquences aucune homologie n'a été trouvée et la fonction de ces gènes partiellement séquencés reste inconnue. Quant au séquençage génomique systématique, il a été rendu possible grâce aux banques génomiques ordonnées en YACs et au sous-clonage de ces YACs en fragments plus petits. L'entreprise est difficile, du fait des séquences répétées très délicates à ordonner les unes par rapport aux autres, même chez l'arabette, notamment les régions centromériques, télomériques et celles de l'ADN ribosomique. Une organisation s'est mise en place au niveau international où des groupes de laboratoires, avec l'aide financière de l'Union européenne et des instances nationales, se sont répartis de manière coordonnée les différentes régions à séquencer. On estime qu'en 1996 près de 2 Mb d'ADN génomique auront été séquencées chez l'arabette, avec une densité moyenne d'un gène toutes les 4 500 paires de bases. La plupart des gènes possèdent un nombre d'introns variant de 1 à 10, certains en ont plus de 25. Seule la connaissance préalable des ADN-c a permis de détecter les exons très courts de certains gènes.
L'analyse fonctionnelle
Plus on progresse dans les programmes de séquençage et plus on découvre notre ignorance de la fonction des très nombreux gènes décrits. Deux grandes directions de recherches se développent actuellement pour résoudre ce problème. L'une s'appuie sur le développement de programmes informatiques de l'analyse des séquences : la définition de motifs récurrents, la fréquence d'utilisation des codons sont deux exemples d'analyse in silico permettant de regrouper des gènes en fonction de leurs séquences nucléotidiques. Si ces gènes ont une fonction commune ou participent à une même voie métabolique, on pourra proposer un rôle au gène codé par une séquence nouvelle.
L'autre direction s'appuie sur des techniques de généticiens. Des méthodes originales de mutagenèse utilisent la possibilité de transformer génétiquement les plantes par des plasmides bactériens. C'est le cas de l'arabette transformée par le plasmide Ti d'Agrobacterium tumefaciens (l'agent de la gale du collet). Le plasmide a été « désarmé » pour que les plantes ne développent plus la maladie, et il est maintenant porteur d'une construction particulière. Capable de s'insérer au hasard dans le génome, il génère une mutation à chaque fois qu'il interrompt la séquence d'un gène. Un programme de « mutagenèse à saturation » a été entrepris à l'INRA de Versailles en utilisant ces méthodes. L'objectif est de créer des mutants pour tous les gènes exprimés, dont le nombre est estimé entre 20 000 et 25 000. Le plasmide bactérien reconstruit comporte un gène de résistance à un herbicide pour sélectionner les plantes transformées. Il sert également d'« hameçon moléculaire » permettant de remonter au gène interrompu par l'insertion de cette construction, de le cloner et de le séquencer. Toute la batterie des analyses physiologiques, biochimiques, cytologiques est utilisée pour décrire ces collections de transformants et découvrir le rôle des gènes mutés. On peut aussi « complémenter », c'est-à-dire restaurer le fonctionnement normal, des mutants déjà décrits de plantes ou de levures en les transformant par des séquences sans fonction, et donc assigner a posteriori un rôle à ces gènes inconnus.
Les applications
L'établissement des cartes génétiques chez les végétaux cultivés a un intérêt qui n'est pas uniquement académique. On peut aujourd'hui sélectionner beaucoup plus efficacement les variétés cultivées en contrôlant au cours des croisements la transmission des allèles favorables des gènes importants. Ce sont soit les gènes eux-mêmes que l'on caractérise au niveau moléculaire, soit les marqueurs proches de ces gènes.
La sélection assistée par marqueurs
La sélection végétale fait appel pour l'essentiel aux méthodes statistiques de la génétique quantitative, car les caractères que l'on souhaite améliorer sont complexes. Le rendement, la rusticité, ou la précocité, par exemple, résultent de l'expression coordonnée d'un grand nombre de gènes. De tels caractères ne se répartissent pas de façon simple dans une descendance et n'obéissent pas aux lois de Mendel qui s'appliquent à des caractères gouvernés par un très petit nombre de gènes. Grâce à l'établissement de cartes génétiques qui couvrent l'ensemble des chromosomes, on peut aujourd'hui localiser les QTLs (pour Quantitative Trait Loci), c'est-à-dire les locus impliqués dans l'expression des caractères quantitatifs. En balayant tous les marqueurs de la carte les uns après les autres et en associant aux différentes formes alléliques la valeur du caractère considéré (par des analyses de variance, par exemple) on peut définir les zones chromosomiques (voire les gènes) qui contribuent plus ou moins à l'expression de ce caractère. Ainsi il devient possible de réaliser une sélection plus efficace, plus précoce et pour de nombreux gènes simultanément.
Les plantes transgéniques
La possibilité de transformer génétiquement les plantes représente l'autre direction privilégiée des créateurs de nouvelles variétés (→ transgenèse végétale, OGM). À partir du moment où un gène est cloné il est possible, pour un certain nombre d'espèces, de l'intégrer au génome de la plante et de le faire s'exprimer. On peut réaliser cette transformation en utilisant comme vecteur des plasmides bactériens. On peut aussi transformer directement des cultures cellulaires en les bombardant avec de minuscules billes de métal enrobées de l'ADN à introduire. La faculté que possèdent les plantes de régénérer un individu entier à partir d'une cellule quelconque permet alors de récupérer des individus transformés et de les multiplier.
De nombreux exemples sont déjà bien connus : celui de la tomate dont le mûrissement peut être retardé par l'introduction d'un gène (le transport devient alors plus aisé du fait de sa fermeté) ou encore ces nouvelles variétés de colza ou de betterave résistantes à un herbicide qui facilitent la tâche des agriculteurs. Pour le colza comme pour la betterave on connaît des espèces proches, au sens géographique comme au sens évolutif, avec lesquelles des hybridations naturelles se produisent et qui peuvent à leur tour acquérir le transgène.
Ces quelques exemples posent des questions qui, sans être de même nature que les questions éthiques, interpellent le législateur comme le simple citoyen. Pourtant il faut aussi garder à l'esprit que, pour les nombreuses espèces de plantes où la transgenèse est aujourd'hui possible, on va pouvoir réduire considérablement l'épandage d'engrais et de pesticides, et sauvegarder notre environnement, avec des plantes plus efficaces et plus résistantes aux différents ravageurs. En plus des instances internationales, deux comités d'experts indépendants ont été mis en place en France, la Commission de génie génétique et la Commission de génie biomoléculaire, pour réfléchir à ces questions et réglementer les pratiques des laboratoires et des entreprises commerciales.
On a récemment introduit chez le peuplier un gène contrôlant certaines étapes de la floraison de l'arabette. Les peupliers transformés ont fleuri la première année de leur culture, alors qu'il faut normalement une dizaine d'années pour qu'un peuplier fasse des fleurs. On imagine l'immense intérêt pour les généticiens des arbres de pouvoir raccourcir le temps de génération.
Génomes mitochondriaux et chloroplastiques
Les génomes mitochondriaux des plantes
Les mitochondries sont de petits organites de la taille d'une bactérie. Elles sont le site des réactions terminales de la respiration cellulaire. Elles consomment de l'oxygène, dégagent du gaz carbonique et fabriquent de l'ATP, molécule de stockage de l'énergie dans la cellule. Les membranes internes contiennent une chaîne de transfert d'électrons, des pompes à protons et le complexe enzymatique responsable de la synthèse d'ATP. Il est maintenant clairement établi que les mitochondries dérivent d'une espèce de bactérie qui vivait de manière autonome il y a 3 milliards d'années, et qui se serait trouvée incluse dans une cellule eucaryote. Tous les animaux, plantes, champignons et presque tous les protozoaires contiennent des mitochondries, provenant probablement toutes du même événement originel d'endosymbiose.
Les génomes mitochondriaux des plantes supérieures possèdent des caractéristiques qui les distinguent de ceux des autres eucaryotes. Ils ont une taille plus importante et beaucoup plus variable, de 200 kb chez les brassicacées à 2 500 kb chez les cucurbitacées, contre 16 à 20 kb chez les mammifères. Les cartes génétiques et physiques des génomes mitochondriaux des plantes sont représentées sous la forme de cercles-maîtres. Un cercle-maître peut être défini comme une représentation sur un cercle de l'ensemble de l'information génétique d'un génome mitochondrial.
On a récemment séquencé entièrement le génome mitochondrial d'une plante épiphyte, Marhantia polymorpha, ceux de l'arabette et du riz étant en cours d'achèvement. La caractéristique la plus frappante de ces génomes est la présence de séquences répétées variables en taille, en nombre de répétition et en orientation sur le cercle-maître. Ces séquences répétées sont impliquées dans des recombinaisons entre molécules d'ADN mitochondrial, une mitochondrie comportant plusieurs molécules d'ADN de tailles différentes résultant d'une intense activité recombinatoire. Cette flexibilité du génome mitochondrial est à l'origine d'une variabilité génétique importante. On peut ainsi trouver plusieurs types mitochondriaux au sein d'une même espèce et même au sein d'une même population, comme chez le thym. On peut aussi induire artificiellement cette variabilité en réalisant la fusion somatique de protoplastes (cellules débarrassées de leur paroi rigide) provenant d'espèces ou de genres différents. Les « cybrides » (pour cytoplasmes hybrides) obtenus disposeront de nouveaux génomes mitochondriaux, résultant de recombinaisons entre les ADN parentaux. Dans les croisements réalisés par les voies naturelles, le génome mitochondrial est très généralement hérité par voie maternelle (hérédité cytoplasmique) et ces événements ne se produisent pas.
Malgré leur grande variabilité en taille, les génomes mitochondriaux des plantes semblent tous avoir le même contenu en information génétique : de 100 à 120 gènes, y compris ceux codant pour les ARN de transfert et les ARN ribosomiques. Ils codent pour certaines sous-unités des complexes de la chaîne respiratoire, de l'ATP synthase, des ribosomes et pour quelques protéines de fonction encore inconnue.
Un phénomène particulier a été décrit dans les mitochondries végétales, c'est l'« édition » des messagers. Le transcrit primaire, l'ARN directement transcrit de l'ADN, peut subir des modifications post-transcriptionnelles transformant spécifiquement certaines cytidines en uraciles. La conséquence en est une modification des codons de l'ARN messager, qui sera traduit en protéine. Avant cette découverte, la séquence d'acides aminés des protéines ne correspondant pas à la suite des codons de l'ADN, on avait pensé que le code génétique n'était pas le même chez ces organites que dans le reste du monde vivant ! C'est d'ailleurs partiellement vrai dans certaines mitochondries d'animaux ou de micro-organismes.
Une autre particularité remarquable des mitochondries végétales est qu'elles sont à l'origine d'un phénomène à hérédité maternelle, décrit depuis longtemps et très fréquent chez les plantes supérieures, la stérilité mâle cytoplasmique. Les plantes possédant un génome mitochondrial inducteur de stérilité sont incapables de fournir un pollen fécondant, le blocage pouvant se situer selon les cas à différentes étapes du programme de développement des organes mâles. L'expression de cette stérilité peut toutefois être contrebalancée par un (ou plusieurs) gène(s) nucléaire(s), dit(s) « restaurateur(s) de fertilité ». Les plantes « restaurées » produiront du pollen, même avec un génome mitochondrial inducteur de stérilité. Ce phénomène a été largement exploité par les généticiens, puisqu'il permet de contrôler les croisements sans avoir à stériliser mécaniquement ou chimiquement les organes mâles des fleurs.
Le génome chloroplastique
Dans les chloroplastes s'effectue la fixation du carbone atmosphérique, base de la vie sur Terre (→ photosynthèse). Chacun de ces organites possède plusieurs copies d'un génome circulaire mesurant de 120 à 217 kb (150 kb en moyenne) chez les plantes supérieures. Ce génome s'apparente à celui des cyanobactéries, attestant de la probable origine endosymbiotique des plantes (selon un phénomène similaire à celui qui est à l’origine mitochondries).
Le séquençage complet de l'ADN chloroplastique a été réalisé chez plusieurs plantes très éloignées au sens évolutif (algues, bryophytes, gymnospermes, angiospermes). Chez les plantes terrestres, l'organisation de ce génome circulaire est remarquablement conservée. Le génome chloroplastique se caractérise chez la plupart des espèces, à l'exception de certaines légumineuses et des conifères, par la duplication d'une région contenant l'ADN ribosomique chloroplastique. Les deux répétitions sont inversées et séparent une grande et une petite région d'ADN en copie unique. Par recombinaison au niveau de ces séquences, deux isomères de la molécule d'ADN sont obtenus qui diffèrent par l'orientation de ces deux régions non répétées.
Les gènes de l'ADN chloroplastique se répartissent en deux catégories, ceux impliqués dans l'expression des gènes et ceux ayant une fonction bioénergétique. La première catégorie inclut tous les ARN nécessaires à l'expression des gènes (30 ARN de transfert et 4 ARN ribosomiques), 21 protéines ribosomiques et 4 sous-unités de l'ARN polymérase. La seconde catégorie comprend 29 gènes impliqués dans la photosynthèse et 11 dans la photorespiration. Parmi eux se trouve le gène rbcL qui code pour la grande sous-unité de la ribulose biphosphate carboxylase. Cette enzyme clé de la photosynthèse, qui fixe le CO2, est de loin la protéine la plus abondante sur la Terre, représentant près de 50 % des protéines foliaires. Elle est constituée de sous-unités codées par le génome chloroplastique et par le génome nucléaire, illustrant l'étroite collaboration entre les deux génomes. Une douzaine d'autres gènes codent pour des protéines de fonction encore inconnue.
Bien que des séquences d'ADN chloroplastique se retrouvent fréquemment dans le génome nucléaire ou mitochondrial, le contraire n'est pas vrai, cela étant peut-être lié au compactage assez poussé du génome chloroplastique. Quelques gènes possèdent néanmoins des introns, et le phénomène d'« édition » des messagers, moins fréquent que dans les mitochondries, a également été décrit dans les plastes.
Du fait de son taux d'évolution assez lent, le séquençage de certaines portions de l'ADN chloroplastique, en particulier du gène rbcL, permet de retracer l'évolution des grandes familles de plantes, à l'aide de reconstructions phylogénétiques. Le mode de transmission de ce génome fait également l'objet de l'attention des généticiens. En effet, s'il est généralement hérité maternellement, il existe d'importantes exceptions : d'une part de nombreuses espèces d'angiospermes transmettent de façon épisodique leurs chloroplastes par voie paternelle, d'autre part des groupes entiers comme les conifères transmettent leur ADN chloroplastique par voie exclusivement paternelle, alors même que leur ADN mitochondrial est transmis maternellement. Schéma de trois complexes protéiques de la chaîne respiratoire et de l'ATP synthase qui contiennent des sous-unités codées par l'ADN mitochondrial. Le Complexe I oxyde le NADH et transfère les électrons à l'ubiquinone (UQ). De là les électrons transitent par le Complexe III, le cytochrome C et le Complexe IV, où ils sont utilisés pour réduire l'oxygène. Les Complexes I, III et IV utilisent l'énergie fournie par ces réactions pour pomper les protons (H+) vers l'espace intermembranaire. L'ATP synthase utilise l'énergie fournie par le retour de ces protons pour fabriquer l'ATP. Les gènes mitochondriaux codant pour les différentes sous-unités sont indiqués sur chacun des complexes (en italique). Chaque complexe contient aussi plusieurs sous-unités codées par le génome nucléaire (au moins une trentaine pour le Complexe I, au moins 6 pour le Complexe III, 8 pour le Complexe IV et 6 pour l'ATP synthase). Dans la membrane interne des mitochondries végétales se trouvent plusieurs autres NADH oxydases, le Complexe II et l'oxydase alternative qui n ont pas été inclus dans ce schéma parce qu'ils ne contiennent pas des sous-unités codées par le génome mitochondrial.






