benzène
(de benzoïque)

Hydrocarbure monocyclique de formule C6H6, prototype des arènes, appelé communément benzine. (Synonyme : phène.)

Découvert en 1826 par Faraday, le benzène a été isolé des goudrons de houille et synthétisé en 1866 par Berthelot à partir de l'acétylène. Longtemps obtenu par distillation de la houille, il est aujourd'hui préparé industriellement par cyclisation et aromatisation des hydrocarbures saturés. La structure du benzène et de ses dérivés a posé un problème à la chimie organique classique. Pour le résoudre, Kekulé proposa, en 1866, qu'il était nécessaire de prévoir en fait 2 formules, apparemment identiques pour le benzène, mais différentes pour ses dérivés.
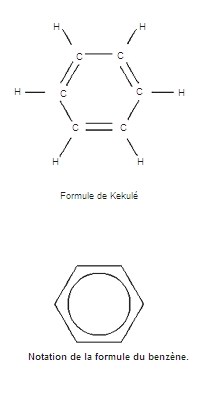
L'analyse radiocristallographique soutenue par les théories quantiques a montré que la structure du benzène est en fait celle d'un hexagone régulier formé par les 6 atomes de carbone, chacun étant lié aux 2 atomes de carbone et à l'atome d'hydrogène les plus proches par des liaisons σ coplanaires, à 120° les unes des autres. L'édifice du plan ainsi formé est entouré de part et d'autre par un nuage de 6 électrons π délocalisés sur les 6 atomes de carbone qui assurent la cohésion finale de l'ensemble. L'enthalpie calculée pour la formation d'une molécule fictive ayant la formule de Kekulé est inférieure de 36 kcal/mole (énergie dite de résonance) à l'enthalpie réelle de formation du benzène. Liquide incolore, peu dense (0,884) et doué d'une odeur caractéristique, le benzène fond à 5,4 °C et bout à 80,4 °C. C'est un bon solvant des composés organiques, du phosphore, du soufre, de l'iode. Inflammable, il brûle avec une flamme fuligineuse. Il est relativement peu réactif. Le chlore, en présence de catalyseurs, peut substituer jusqu'à 6 atomes d'hydrogène ; la sulfonation donne l'acide benzènesulfonique ; la nitration le nitrobenzène ; l'acylation des cétones R―CO―C6H5. L'hydrogène s'additionne en donnant le cyclohexane C6H12, le chlore en donnant l'hexachlorocyclohexane C6H6Cl6. L'importance industrielle du benzène est considérable. Il est utilisé à la fabrication de phénol, de styrène, de cyclohexane, d'aniline, d'insecticides.