acides et bases

Les acides et les bases sont des espèces chimiques, molécules ou ions, qui interviennent dans les nombreuses réactions de type « acido-basique ».
1. Notion d'acide et de base
Acide et base conservent dans le langage quotidien les mêmes connotations qu'à l'époque de la Révolution française, lorsque les savants en étaient aux premiers balbutiements de la chimie en tant que science.
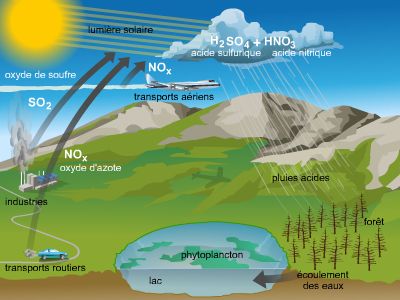
Dans le langage courant, on utilise le terme acide pour signifier qu'un fruit pas assez mûr est piquant ou mordant au goût. Le mot a une connotation désagréable : ainsi, les pluies acides évoquent la ruine de la végétation, et l'on va jusqu'à qualifier d’« acides » des propos acerbes. Quant au mot base, il évoque plus un appui qu'une quelconque référence à la chimie.
1.1. Historique des études sur les acides et les bases

Les premiers acides, découverts au xiiie s., sont des acides minéraux : l'acide sulfurique (huile de vitriol), l'acide nitrique (eau-forte) et l'acide chlorhydrique (esprit de sel). Il faudra attendre le xviie s. pour que le dioxyde de carbone (« gaz sylvestre ») soit découvert. Au cours de ce même siècle commence la production industrielle de l'acide sulfurique, nécessaire aux préparations des teintures et à la purification des métaux comme l'or.

Robert Boyle propose le premier moyen permettant de caractériser les composés par l'action de leur solution aqueuse sur un indicateur coloré, le sirop de violette. Le virage de cet indicateur lui permet de classer les composés en deux catégories : acide, alcali (base). Les premières études sur la concentration des solutions acides sont faites au xviiie s. : Antoine Baumé en mesure les densités ; Karl Friedrich Wenzel observe l'attaque des métaux ; Antoine Laurent de Lavoisier mène à bien des travaux sur la composition de l'air, ce qui le conduit à abandonner la théorie du phlogistique. Ce dernier, par une rigueur scientifique rare à cette époque et par les déductions qu'il tire d'expériences méticuleuses, élabore une méthode de nomenclature chimique selon laquelle acides et oxygène sont liés. Cette théorie prévaut jusqu'à ce que sir Humphry Davy, ayant démontré que l'acide chlorhydrique (HCl) ne contient pas d'oxygène, suggère que l'acidité pourrait provenir de l'hydrogène.
1.2. Acides et bases dans la vie de tous les jours
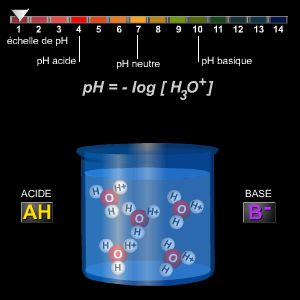
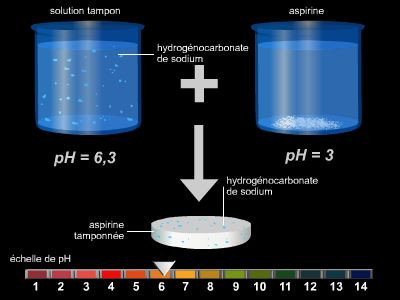
L'introduction de la notion d'acidité conduit à définir une grandeur qui la mesure : dans l'eau son nom est le pH, sa valeur est de 7 à la neutralité. Une solution est dite acide si son pH est inférieur à 7, basique si son pH est supérieur à 7, neutre si son pH est égal à 7.
Souvent, l'eau du robinet est légèrement acide, mais ce n'est guère inquiétant, car de toute façon les aliments, boissons, fruits, légumes sont à tendance acide (le citron contient de l'acide citrique, l'oseille de l'acide oxalique, le vinaigre est une solution d'acide éthanoïque).
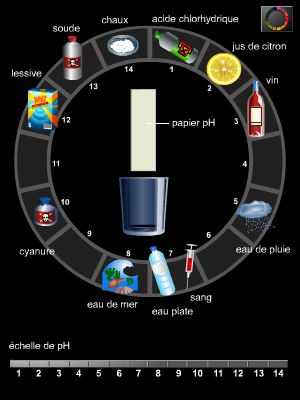
Ainsi, le pH d'un jus de citron est voisin de 2,3 ; celui des sodas au cola est de 2,6 ; celui du vinaigre est de 2,8 ; le jus de pomme a un pH de 3,6 ; le pH du whisky est de 4,3. Le suc gastrique (→ estomac), lui, a un pH de 1,5, alors que la salive est à 6,5 et l'urine à 6.
Notre peau, notre chevelure, constituées d'acides aminés organisés en protéines, supportent les produits de nettoyage légèrement acides, tels les shampooings et pommades pour la peau. Les produits ménagers de nettoyage, quant à eux, appartiennent à la catégorie basique (l'eau de Javel concentrée a un pH de 10,7), d'où la difficulté à ne pas faire feutrer la laine, à base d'acides aminés elle aussi, car les réactions acide-base dégagent de la chaleur.
Le caractère acide ou basique ne concerne pas exclusivement l'homme. Les végétaux se développent plus ou moins bien selon le degré d'acidité du sol. Ainsi, la myrtille prolifère dans un sol dont la gamme de pH est de 3,5 à 5,0, alors que le fraisier demande un sol d'un pH de 7,0 à 8,0.
2. L'eau, un acide ou une base ?
Présente partout, l'eau sert de référence dans la mesure de l'acidité. Cependant, la neutralité de pH pour l'eau est un cas rare : en effet, l'eau naturelle ayant solubilisé des roches dans son trajet ne se trouve pas forcément à pH = 7.
2.1. L'ionisation

L'eau (liquide entre 0 °C et 100 °C) est constituée de molécules H2O, sortes de petits dipôles qui peuvent rendre dissymétrique la liaison A–B existant entre deux constituants d'une molécule notés A et B ; ce faisant, elle provoque l'apparition d'une ionisation plus ou moins partielle sur A et B. Par exemple, selon la tendance chimique des constituants, on obtient la paire d'ions δ+A–Bδ− ou δ−A–Bδ+.
Plus la valeur du moment dipolaire μ du solvant est grande, plus les molécules sont des dipôles puissants. L'eau possède un moment dipolaire assez élevé, μ = 1,8 D (debye). [Le Néerlandais Peter Debye reçut le prix Nobel de chimie en 1936 pour ses travaux sur les moments dipolaires.]
2.2. La dissociation ionique
L'eau est aussi un composé moléculaire, et sa constante diélectrique ε présente la valeur la plus forte de tous les composés (ε = 78 à 25 °C) à une exception près, celle de la formamide HCONH2. Or, d'après les travaux du physicien français Charles Augustin de Coulomb, on sait que la force d'attraction entre deux charges de signes opposés est d'autant plus faible que ε est grand. Dans l'eau, l'ionisation en paires d'ions δ+A–Bδ− peut être portée jusqu'à la dissociation en ions A+ et B−.
2.3. La solvatation
Dans l'eau, les ions A+ et B− ne demeurent pas isolés : ils se trouvent entourés d'un cortège de molécules d'eau, car les dipôles sont attirés par les ions selon les lois de l'électrostatique. On dit que les ions sont solvatés. Pour ne pas surcharger l'écriture, on indique la présence de molécules d'eau autour d'un ion en accolant le terme aq (abréviation de aqueux) – par exemple : Cl−(aq) –, à moins que la compréhension du raisonnement tenu ne s'éclaire en précisant le nombre de molécules d'eau présentes autour de l'ion. Ainsi, pour les cations métalliques, on va jusqu'à donner le nombre de molécules d'eau présentes en décrivant la structure de ces cations, ce qui donne pour le zinc ou pour l'aluminium : [Zn(H2O)4]2+ ou [Al(H2O)6]3+.
En revanche, pour le proton H+(aq), on ne prend en compte qu'une molécule d'eau par ion et, par commodité, on écrit H3O+ (ion hydronium).
2.4. Un acide dans l'eau
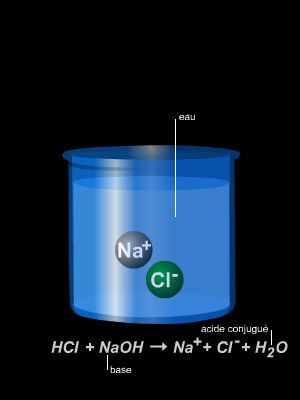
Bien que le chimiste danois Johannes Nicolaus Brønsted ait généralisé la définition des acides donnée cinquante ans plus tôt par le Suédois Svante Arrhenius, en faisant une proposition qui s'applique à tous les solvants, nous énoncerons cette définition en utilisant uniquement l'eau comme solvant : un acide dans l'eau est un corps en solution qui libère l'ion H+, proton hydraté que l'on écrit H+(aq).
Ainsi, le gaz chlorure d'hydrogène (HCl), les liquides acide sulfurique (H2SO4) ou acide acétique (CH3CO2H), appelé éthanoïque dans la nomenclature systématique, le solide chlorure d'aluminium (AlCl3) provoquent après dissolution dans l'eau les réactions suivantes :

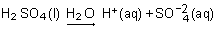

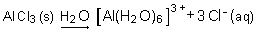
Toutes ces solutions ont donc en commun la présence d'ions H+(aq) et en possèdent les propriétés, notamment celle de réagir sur le métal zinc pour produire le gaz hydrogène H2 par une réaction de type oxydoréduction.
2.5. Auto-ionisation de l'eau
L'eau pure ne conduit pratiquement pas le courant. On peut cependant détecter, en effectuant des mesures de tension très précises, la présence d'une infime quantité d'ions H+(aq), et par voie de conséquence d'ions HO−(aq) selon l'équilibre :
H2O ⇄ HO−(aq) + H+(aq)
La double flèche traduit le fait que les faibles quantités d'ions sont en équilibre avec les molécules d'eau non dissociées, toujours en excès.
Si l'on choisit de représenter H+(aq) par H3O+, la réaction de dissociation de l'eau s'écrit :
H2O (1) + H2O (2) ⇄ HO− + H3O+
On peut rapprocher H2O (1)/HO− et H3O+/H2O (2) en mettant en évidence deux couples, dits couples acido-basiques.
Il est possible par ailleurs de caractériser cet équilibre par une constante Ke, définie par :
Ke = [H3O+] [HO−]
Les grandeurs entre crochets sont les concentrations d'ions, exprimées en nombre de moles par litre (ou encore mol . dm−3) ; ces ions, il faut le rappeler, sont en très faible quantité, et [H2O], infiniment grand par rapport à [H3O+] et [HO−], reste pratiquement constant et est inclus dans Ke.
Ke est appelé la constante d'autoprotolyse, car le proton libéré provient de la scission d'une première molécule d'eau (couple H2O/HO−) et se fixe sur une deuxième molécule (couple H3O+/H2O).
Par commodité d'écriture, on a été amené à introduire :
pKe = − log Ke
(relation par rapport aux puissances de 10 avec Ke = 10−pKe).
Dans l'eau pure à 25 °C, Ke = 10−14 ; on en déduit que : [H3O+] = [HO−] = 10−7 mol . l−1. Cette valeur très faible pourrait être comparée à la présence d'un seul habitant, sans ascendant, sans descendant, se nommant proton aqueux (H3O+), dans la région parisienne (11 millions d'habitants).
3. Le couple acide-base
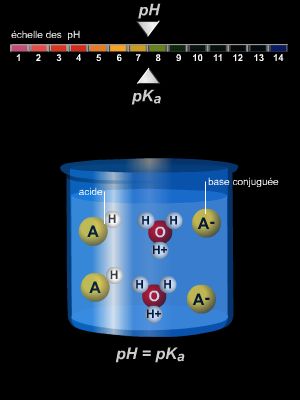
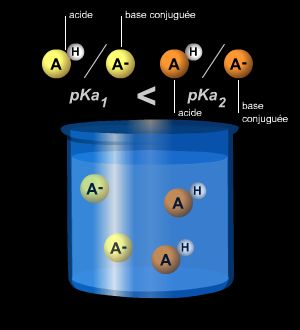
Acide et base conjugués forment un couple en équilibre, auquel il est possible d'associer une constante de dissociation K, qui met en jeu les concentrations des différentes espèces en solution.
3.1. La constante d'acidité KA
On ne peut concevoir l'existence d'un acide sans celle de la base correspondante. À l'acide éthanoïque (CH3CO2H) correspond l'ion éthanoate (CH3CO2−) par libération du proton selon le schéma :
CH3CO2H + H2O ⇄ CH3CO2− + H3O+
en prenant soin de porter une double flèche entre les produits de départ et les produits d'arrivée, car la réaction n'est peut-être pas totale mais simplement équilibrée. On s'aperçoit qu'à CH3CO2H correspond CH3CO2−, et qu'à H2O correspond H3O+.
Puisqu'un acide, selon la définition de Brønsted, cède en solution un proton, CH3CO2H et H3O+ sont des acides. Nous appelons base leur correspondant respectif qui capte ce proton. On définit ainsi un couple acide-base conjugué qui échange un proton, par exemple :
CH3CO2H/CH3CO2− ou H3O+/H2O
L'équilibre précédent n'est donc qu'une réaction entre deux couples acide-base conjugués qui sont en compétition pour s'emparer du proto ; l'un des couples (H3O+/H2O) joue un rôle privilégié, puisqu'il est aussi solvant.
L'équilibre :
acide 1 + base 2 ⇄ base 1 + acide 2
peut s'écrire :
CH3CO2H + H2O ⇄ CH3CO2− + H3O+
La constante d'équilibre KA s'appelle constante d'acidité. Le solvant étant toujours en excès, sa concentration est pratiquement constante, et on peut écrire :

Plus l'acide cède facilement son proton, plus il est fort et plus [H3O+] est important, donc plus grande est la valeur de KA. Lorsque la réaction est totale, KA est infini : c'est le cas de l'acide chlorhydrique HCl.
Par commodité, on repère la force de l'acidité par rapport aux pKA, ainsi
pKA = − log KA (KA = 10−pKA)
Ainsi, plus l'acide est fort, plus la valeur de pKA est petite, et réciproquement; cela permet de classer les acides à partir du tableau des valeurs de pKA.
3.2. La constante de basicité KB
En prenant l'exemple d'un corps réputé être une base, l'ammoniac (NH3), l'équilibre :
acide 1 + base 2 ⇄ base 1 + acide 2
s'écrit :
H2O + NH3 ⇄ HO− + NH4+
et la constante de cet équilibre, dite constante de basicité, est :
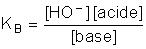
En fait, cette nouvelle constante s'avère inutile. Si nous avions considéré l'acide NH4+ (ion ammonium), son équilibre dans l'eau se serait écrit :
NH4+ + H2O ⇄ NH3 + H3O+
équilibre caractérisé par la constante KA.
Il est possible d'en déduire, en introduisant Ke, que pour le couple acide-base NH4+/NH3, comme pour tous les couples acide-base conjugués, la somme des constantes d'acidité et de basicité est :
pKA + pKB = pKe
Tous les couples acide-base peuvent donc être répertoriés par leur seul pKA.
3.3. Les valeurs limites des pKA dans l'eau
Dans l'eau existent les deux couples H2O/HO− et H3O+/H2O. L'eau (H2O), à laquelle on peut associer la base conjuguée HO− et l'acide conjugué H3O+, est ainsi un ampholyte.
L'équilibre :
acide + H2O ⇄ base + H3O+
devient une réaction totale pour tout acide plus fort que l'acide H3O+.
Réciproquement, l'équilibre :
H2O + base ⇄ HO− + acide
devient une réaction totale pour toute base plus forte dans l'eau que l'ion HO−.
Dans l'eau, il n'est possible de différencier que les acides et les bases dont les valeurs de pKA sont comprises entre 0 et 14. En effet, tous les acides plus forts que H3O+ ne peuvent pas être différenciés : on dit qu'ils sont nivelés. Réciproquement, toutes les bases plus fortes que HO− ne peuvent pas être différenciées : elles sont également nivelées. Pour les différencier, il faut prendre un solvant plus basique que l'eau.
Dans des séries de constituants, selon que la formule chimique influence peu le départ du proton ou, au contraire, qu'elle ait une forte répercussion, les pKA des acides concernés varient peu ou beaucoup.
Ainsi, dans la série des acides monocarboxyliques, les constantes d'acidité (pKA) varient peu de l'acide méthanoïque (3,77) au n-octanoïque (4,85). En revanche, dans les composés aromatiques, la présence du noyau benzénique fait qu'entre le phénol et son dérivé substitué trinitré, nommé aussi acide picrique, le pKA passe de 9,84 à 0,38.
Pour les acides plus forts que H3O+, il n'est plus possible de mesurer le pKA, mais il se calcule et les valeurs trouvées sont inférieures à 0 :
pKA de H2SO4/HSO4− = − 7,5
(HSO4− : ion hydrogénosulfate) ;
pKA de HCl/Cl− = − 7
(Cl− : ion chlorure).
3.4. Peut-on prévoir la réaction entre deux couples acido-basiques ?
Dans l'équilibre :

deux couples acide 1/base 1 et acide 2/base 2 sont en compétition pour s'emparer du proton de l'autre couple. La constante de l'équilibre est :

où KA1 et KA2 sont les constantes d'acidité des deux acides (acide 1, acide 2). Si cet équilibre est très déplacé dans le sens 1, alors K >> 1, et KA1 >> KA2. L'acide 1 est donc bien plus fort que l'acide 2.
Il est donc possible de prévoir le sens de la réaction par la boucle :
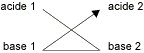
avec pKA1 < pKA2 et pK = pKA1 − pKA2.
Par exemple, comme le pKA de NH4+/NH3 = 9,25 et que le pKA de HCO3−/CO32− = 10,32, la réaction :

peut être prévue dans le sens 1 (NH4+ est l'ion ammonium, HCO3− l'ion hydrogénocarbonate).
De même, l'acide nitrique (pKA = − 3), acide moins fort que l'acide sulfurique (pKA = − 7,5), se comporte en base vis-à-vis de ce dernier selon la réaction :

Cette réaction est utilisée pour nitrer les dérivés aromatiques grâce à l'acide NO2+ (ion nitronium), obtenu ici en plus grande quantité que par la réaction d'autoprotolyse de l'acide nitrique. La notion de relativité du comportement chimique d'un corps apparaît nettement, elle ne dépend que de la nature de l'autre corps mis en réaction : ainsi, l'acide nitrique est bien un acide (comme il est dit dans son appellation) par rapport à l'eau, mais c'est une base par rapport à l'acide sulfurique.