équation de Van der Waals
Équation d'état des fluides obtenue en tenant compte, dans une certaine mesure, des forces d'interaction entre molécules.
Cette équation d'état est une approximation simple qui rend mieux compte des propriétés des gaz et liquides réels que l'équation des gaz parfaits. L'équation de Van der Waals lie la pression p, la température T et le volume V d'un fluide constitué de N molécules :
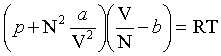
, où R est la constante des gaz parfaits, a et b deux constantes dépendant du fluide considéré.
La constante b, appelée covolume, représente le volume minimal que l'on peut considérer comme étant occupé par une mole : en effet, à courte distance, deux moles se repoussent, et cette répulsion, due au principe d'exclusion de Pauli, rend impossible la compression du gaz dans un volume arbitrairement faible. Le terme
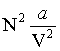 , appelé pression interne, résulte des forces d'interaction de Van der Waals.
, appelé pression interne, résulte des forces d'interaction de Van der Waals.
Lorsque le terme
 devient très grand (faibles pressions), on peut négliger le covolume et la pression interne, et l'on retrouve l'équation des gaz parfaits.
devient très grand (faibles pressions), on peut négliger le covolume et la pression interne, et l'on retrouve l'équation des gaz parfaits.



